题目内容
7.在托盘天平的两盘上各放一只质量相同的烧杯,在两只烧杯里分别加入等质量、等溶质质量分数的稀硫酸,将天平调节至平衡.然后向左盘的烧杯中加入8.4g铁,反应物之间恰好完全反应.欲使天平恢复平衡,则可向右盘的烧杯中加入( )| A. | 8.4g 铝 | B. | 8.4g氧化钙 | C. | 8.4g 锌 | D. | 8.4g碳酸镁 |
分析 可以用差量法进行计算,左盘烧杯中增加的质量和右盘烧杯中增加的质量相等时,天平保持平衡.
解答 解:设与8.4g铁反应的硫酸的质量为X,生成氢气的质量为Y,
Fe+H2SO4═FeSO4+H2↑
56 98 2
8.4g X Y
$\frac{56}{8.4g}=\frac{98}{X}=\frac{2}{Y}$
X=14.7g,Y=0.3g.
由计算可知,当向左盘的烧杯中加入8.4g铁时,生成0.3g氢气,左盘中实际增加的质量为:8.4g-0.3g=8.1g;
A、当加入8.4g铝时,铝过量,应该以硫酸的质量计算生成氢气的质量,
解:设加入8.4g铝时,生成氢气的质量为X,
2Al+3H2SO4═Al2(SO4)3+3H2↑
294 6
14.7g X
$\frac{294}{14.7g}=\frac{6}{X}$
X=0.3g,
由计算可知,当向右盘的烧杯中加入8.4g铝时,生成0.3g氢气,右盘中实际增加的质量为:8.4g-0.3g=8.1g;
B、当向右盘的烧杯中加入8.4g氧化钙时,反应后没有气体逸出,右盘中实际增加的质量为8.4g;
C、当加入8.4gX锌时,锌不过量,应该以锌的质量计算生成氢气的质量,
解:设加入8.4g锌时,生成氢气的质量为X,
Zn+H2SO4═ZnSO4+H2↑
65 2
8.4g X
$\frac{65}{8.4g}=\frac{2}{X}$
X=0.26g,
由计算可知,当向右盘的烧杯中加入8.4g锌时,生成0.26g氢气,右盘中实际增加的质量为:8.4g-0.26g=8.14g;
D、当加入8.4g碳酸镁时,硫酸过量,应该以碳酸镁的质量计算生成二氧化碳的质量,
解:设加入8.4g碳酸镁时,生成二氧化碳的质量为X,
MgCO3+H2SO4═MgSO4+H2O+CO2↑
84 44
8.4g X
$\frac{84}{8.4g}=\frac{44}{X}$
X=4.4g
由计算可知,当向右盘的烧杯中加入8.4g碳酸镁时,生成4.4g二氧化碳,右盘中实际增加的质量为:8.4g-4.4g=4.0g;
由以上计算可知,欲使天平恢复平衡,则可向右盘的烧杯中加入8.4g铝.
故选:A.
点评 本题较难,考查的内容较多,需要考虑多方面的知识,要运用多种方法计算.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 用警犬搜救地震中被埋人员--分子在不断运动 | |
| B. | 水烧开后易把壶盖冲起--温度升高,分子变大 | |
| C. | 金刚石与石墨物理性质不同--碳原子的排列方式不同 | |
| D. | 氧气与氢气的化学性质不同--分子构成不同 |
| A. | 甲缩醛属于有机物 | |
| B. | 甲缩醛中碳、氢、氧元素的质量比为3:8:2 | |
| C. | 甲缩醛的相对分子质量为76 | |
| D. | 甲缩醛中碳元素的质量分数约为47.4% |


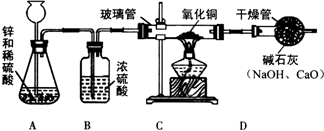 某研究性学习小组的同学用电解水的方法测定水的组成后,提出问题:“测定水的组成还有其他的方法吗?”经过讨论后,得到了肯定的答案,邀请你一起对此展开探究.
某研究性学习小组的同学用电解水的方法测定水的组成后,提出问题:“测定水的组成还有其他的方法吗?”经过讨论后,得到了肯定的答案,邀请你一起对此展开探究. A~H都是初中化学中常见的物质,已知A、B为黑色固体,C为气体,D为红色固体单质,F为红色固体化合物,它们的转化关系如图所示.请回答:
A~H都是初中化学中常见的物质,已知A、B为黑色固体,C为气体,D为红色固体单质,F为红色固体化合物,它们的转化关系如图所示.请回答: