题目内容
10.某地有在丰富的石灰石资源,有招商广告称:“本地石灰石资源丰富,品质优越,碳酸钙含量不低于80%”.一投资商派技术员到实地取回样品,从中称取1.25g与稀盐酸完全反应(杂质不参加反应),测得生成的二氧化碳质量为0.44g.根据检测获得的数据计算判断:该地石灰石中碳酸钙的质量分数并判断其广告的真实性.分析 碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,根据反应的化学方程式,利用反应产生的二氧化碳气体的质量可计算参加反应的碳酸钙的质量;利用样品中碳酸钙的质量分数=$\frac{碳酸钙的质量}{样品的质量1.25g}$,可求得样品中碳酸钙的质量分数,并与广告中碳酸钙含量进行比较,以判断广告的真实性.
解答 解:设参加反应的碳酸的质量为x
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 0.44g
$\frac{100}{x}$=$\frac{44}{0.44g}$ x=1g
样品中碳酸钙的质量分数=$\frac{1g}{1.25g}$=80%.
广告中“碳酸钙含量不低于80%”的宣传真实.
答:该地石灰石中碳酸钙的质量分数是80%,广告中“碳酸钙含量不低于80%”的宣传真实.
点评 利用反应的化学方程式表示物质的质量关系,根据反应中某一物质的质量可计算反应中其它任何物质的质量.

练习册系列答案
相关题目
1.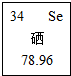 2015年我省固镇县富硒黑花生又喜获丰收,平均亩产达到350公斤.硒是人体必需的14种营养元素之一,与贫血症、冠心病、不孕症、癌症等疾病直接相关,因此,被誉为“生命的奇效元素”.下列关于硒元素的说法中错误的是( )
2015年我省固镇县富硒黑花生又喜获丰收,平均亩产达到350公斤.硒是人体必需的14种营养元素之一,与贫血症、冠心病、不孕症、癌症等疾病直接相关,因此,被誉为“生命的奇效元素”.下列关于硒元素的说法中错误的是( )
 2015年我省固镇县富硒黑花生又喜获丰收,平均亩产达到350公斤.硒是人体必需的14种营养元素之一,与贫血症、冠心病、不孕症、癌症等疾病直接相关,因此,被誉为“生命的奇效元素”.下列关于硒元素的说法中错误的是( )
2015年我省固镇县富硒黑花生又喜获丰收,平均亩产达到350公斤.硒是人体必需的14种营养元素之一,与贫血症、冠心病、不孕症、癌症等疾病直接相关,因此,被誉为“生命的奇效元素”.下列关于硒元素的说法中错误的是( )| A. | 该元素的原子核外电子数为34 | B. | 该元素为非金属元素 | ||
| C. | 该元素的相对原子质量为78.96g | D. | 该元素的原子序数为34 |
18.如表对一些事实的解释,不正确的是( )
| 选项 | 事实 | 解释 |
| A | 物体的热胀冷缩 | 分子大小随温度改变而改变 |
| B | 50mL酒精与50mL水混合后体积小于100mL | 分子之间有一定间隔 |
| C | 衣柜中的“樟脑球”过一段时间会变小甚至消失 | 分子在不断的运动 |
| D | 一氧化碳气体能燃烧,二氧化碳气体不能燃烧 | 不同种分子性质不相同 |
| A. | A | B. | B | C. | C | D. | D |
15.将氯酸钾、二氧化锰、高锰酸钾的混合物装入试管充分加热,直到不再产生气体为止,反应后试管中残渣物质有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
 某同学用如图所示装置测定空气中氧气的体积分数.
某同学用如图所示装置测定空气中氧气的体积分数. 铁制品镑蚀条件的探究实验中:
铁制品镑蚀条件的探究实验中: