题目内容
13.A、B是黑色固体,C、D是白色固体,E、F是无色气体,F能使石灰水变浑浊它们之间有下列转化关系:C$→_{加热}^{A}$D+E、B+E$\stackrel{点燃}{→}$F 根据上述变化确定A--E各为何物,用化学式表示:
AMnO2;BC;CKClO3;DKCl;EO2;FCO2.
分析 首先要知道F可使澄清石灰水变浑浊,且F是气体,所以F是二氧化碳,再根据A和E燃烧生成二氧化碳,且B是黑色固体,所以B是碳,E是氧气,再根据制氧气的方法进行判断即可.
解答 解:二氧化碳具有能使澄清石灰水变浑浊的特点,所以由F可使澄清石灰水变浑浊,且F是气体,所以F是二氧化碳,再根据B和E燃烧生成二氧化碳,且B是黑色固体,所以B是碳,E是氧气,制取氧气的方法有以下几种:过氧化氢溶液与二氧化锰制取氧气,氯酸钾和二氧化锰制取氧气,高锰酸钾制取氧气,而高锰酸钾是紫黑色的,过氧化氢溶液是液体,氯酸钾是白色固体,生成的氯化钾也是白色固体,所以C是氯酸钾,D是氯化钾,通过表达式可知B是催化剂且是黑色固体,所以A是二氧化锰.
故答案为:MnO2;C;KClO3;KCl;O2;CO2.
点评 要知道使澄清石灰水变浑浊的气体是二氧化碳,常见的黑色固体有:二氧化锰、碳、四氧化三铁、铁粉等,还需知道实验室制取氧气的几种方法.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
4.下列变化中属于化学变化的是( )
| A. | 冰融化成水 | B. | 天然气燃烧 | C. | 酒精挥发 | D. | 湿衣服晾干 |
1.一定温度下,一定质量的氢氧化钠固体溶于水制成溶液.下列有关的量不随水的质量改变而改变的是( )
| A. | 溶质质量分数 | B. | 最多能吸收二氧化碳的质量 | ||
| C. | 溶液的pH | D. | 氢氧化钠的溶解度 |
8.下列方法中能鉴别出空气、氧气、二氧化碳三瓶无色气体的是( )
| A. | 分别加入澄清石灰水 | |
| B. | 闻气体的气味 | |
| C. | 分别将燃着的小木条伸入三瓶气体中 | |
| D. | 观察气体的颜色 |
12.下列说法中不正确的是( )
| A. | 炼钢、气焊和宇宙航行等都要用到氧气 | |
| B. | 氦可用于制造低温环境 | |
| C. | 氧气支持燃烧,具有可燃性 | |
| D. | 氮气用于磁悬浮列车 |
13.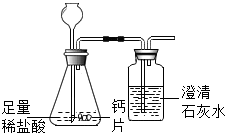 碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
【查阅资料】获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效.这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解.
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳.
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量.
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定.
方案1:根据下图所示装置实验.
(1)锥形瓶中发生反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)长颈漏斗下部插入液面下的目的是防止CO2气体逸出.
(3)加入药品前,检验该装置气密性的方法是夹住胶管(堵住导管出口),从长颈漏斗加水至长颈漏斗中液面高于锥形瓶内液面,若一段时间不下降,则证明该装置气密性良好.
(4)记录数据如下:
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量.记录数据如下(空烧杯质量为100g,加入钙片质量为25g):
【分析和评价】
(1)方案1和方案2中合理的是方案2,原因是澄清石灰水中的Ca(OH)2含量很少(不足),吸收的二氧化碳量很少.
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是加入的糖类、维生素D等物质高温灼烧时会燃烧或分解,导致最终的数据偏大.
(3)要使用【查阅资料】(3)中介绍的方法,还需要学习的是如何测定未知浓度(剩余)盐酸的量.
【结论】经过计算,该钙片中碳酸钙的质量分数是60%.
 碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.【查阅资料】获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效.这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解.
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳.
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量.
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定.
方案1:根据下图所示装置实验.
(1)锥形瓶中发生反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)长颈漏斗下部插入液面下的目的是防止CO2气体逸出.
(3)加入药品前,检验该装置气密性的方法是夹住胶管(堵住导管出口),从长颈漏斗加水至长颈漏斗中液面高于锥形瓶内液面,若一段时间不下降,则证明该装置气密性良好.
(4)记录数据如下:
| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25g | 100g | 200g | 300.4g |
| 加入稀盐酸的质量 | 100g | 200g | 300g | 400g |
| 充分反应后烧杯及杯内物质总质量 | 222.8g | 320.6g | 418.4g | 518.4g |
(1)方案1和方案2中合理的是方案2,原因是澄清石灰水中的Ca(OH)2含量很少(不足),吸收的二氧化碳量很少.
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是加入的糖类、维生素D等物质高温灼烧时会燃烧或分解,导致最终的数据偏大.
(3)要使用【查阅资料】(3)中介绍的方法,还需要学习的是如何测定未知浓度(剩余)盐酸的量.
【结论】经过计算,该钙片中碳酸钙的质量分数是60%.