题目内容
10.如表是KN03和NaCl在不同温度下的溶解度.请回答下列问题:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 /g | KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
| NaCl | 35.7 | 36 | 36.6 | 37.3 | 38.4 | 39.8 | |
(2)20℃时,将KNO3不饱和的溶液,转化成该温度下的饱和溶液的一种方法是增加溶质;
(3)欲配制一定量的NaCl溶液以备稀释使用,你认为40℃时不能(填“能”或“不能”)配制出36.6%的NaCl溶液;
(4)80℃时,把169gKNO3和20gNaCl全部放入100g水中,充分溶解后将溶液降温至0℃时,析出的固体及其质量是155.7g.由此得出从KNO3和NaCl的混合溶液中提纯KNO3的方法是降温结晶.
分析 根据固体的溶解度表可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)通过分析溶解度表中的数据可知,硝酸钾的溶解度受温度影响较大;
(2)20℃时,将KNO3不饱和的溶液,转化成该温度下的饱和溶液的一种方法是增加溶质;
(3)40℃时,饱和氯化钠的质量分数为:$\frac{36.6g}{136.6g}$×100%=26.8%,所以不能配制出36.6%的NaCl溶液;
(4)0℃时氯化钠的溶解度是35.7g,硝酸钾的溶解度是13.3g,所以80℃时,把169gKNO3和20gNaCl全部放入100g水中,充分溶解后将溶液降温至0℃时,析出的固体及其质量是169g-13.3g=155.7g,由此得出从KNO3和NaCl的混合溶液中提纯KNO3的方法是降温结晶.
故答案为:(1)硝酸钾的溶解度受温度影响较大;
(2)增加溶质;
(3)不能;
(4)155.7g,降温结晶.
点评 本题难度不是很大,主要考查了固体的溶解度表所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
1.推理是化学学习中常用的推理方法,下列推理正确的是( )
| A. | 置换反应的生成物为单质和化合物,则有单质和化合物生成的反应一定为置换反应 | |
| B. | 铝表面的氧化铝薄膜能起到保护作用,则铁表面的氧化铁也能起到保护作用 | |
| C. | Na+、Mg2+、Cl+的最外层电子数均为8,由此得出离子的最外层电子数均为8 | |
| D. | 稀盐酸、稀硫酸能使紫色石蕊试液变红,则醋酸也能使紫色石蕊试液变红色 |
18.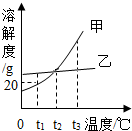 根据如图的溶解度曲线,判断下列说法不正确的是( )
根据如图的溶解度曲线,判断下列说法不正确的是( )
 根据如图的溶解度曲线,判断下列说法不正确的是( )
根据如图的溶解度曲线,判断下列说法不正确的是( )| A. | 甲物质的溶解度随温度的升高而增大 | |
| B. | t1℃时甲物质的饱和溶液中溶质质量分数为20% | |
| C. | 将t2℃时乙物质的饱和溶液降到t1℃,有晶体析出 | |
| D. | t3℃时甲物质的溶解度大于t2℃时乙物质的溶解度 |
15.下列没有运用中和反应原理的是( )
| A. | 用含碳酸氢钠的药物治疗胃酸过多症 | |
| B. | 用熟石灰改良酸性土壤 | |
| C. | 蚊虫叮咬人体分泌出蚁酸,涂上氨水可减轻痛痒 | |
| D. | 印染厂的废水中含有少量氢氧化钠,可加入适量稀硫酸除去 |
2.某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖.对于该溶液的探究,同学们的实验设计合理的是( )
| A. | 取样,在溶液中加入少量的稀盐酸,如果无气泡产生,则可证明该溶液没有变质 | |
| B. | 取样,在溶液中滴加酚酞,如酚酞呈无色,则溶液已完全变质 | |
| C. | 取样,在溶液中加入过量滴有酚酞的氯化钡溶液,如产生白色沉淀,且上层清液呈红色,则溶液未完全变质 | |
| D. | 取样,在溶液中加入过量稀盐酸,则可除去氢氧化钠溶液中产生的杂质 |
19.实验室有一瓶长期露置于空气中的氢氧化钠溶液,确认已变质.某学习小组展开如下探究,确定该溶液的成分,并进一步从变质的溶液中回收氢氧化钠.
【问题1】久置的氢氧化钠溶液是全部变质?还是部分变质?
【探究1】确定该溶液中溶质的成分.
【反思】氢氧化钠溶液变质的原因2NaOH+CO2=Na2CO3+H2O(用化学方程式表示),因此氢氧化钠溶液必须密封保存.
【问题2】如何从变质的氢氧化钠溶液中回收得到较纯净的氢氧化钠固体.
【探究2】回收纯净的氢氧化钠固体.(已知:氢氧化钠溶解度随温度升高增大明显)
请回答下列问题:
(1)试剂X是Ca(OH)2,系列操作z中步骤②的名称是过滤.
(2)探究1中的物质检验和探究2中的除杂提纯都将碳酸钠进行了转化,但二者目的不同,请说明.实验探究1中将碳酸钠转化为氯化钠目的是排除对氢氧化钠检验的干扰实验探究2除杂是为了除去产品中的杂质而将碳酸钠转化为产品氢氧化钠.
【问题1】久置的氢氧化钠溶液是全部变质?还是部分变质?
【探究1】确定该溶液中溶质的成分.
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量溶液于试管中,向溶液中滴加 过量的氯化钙(合理即可)溶液,并不断振荡. | 白色沉淀产生 | 该溶液部分变质,含有 碳酸钠和氢氧化钠. |
| (2)将步骤(1)反应后的混合物静置,取少量上层清液,滴加2~3滴酚酞试液. | 溶液变红色 |
【问题2】如何从变质的氢氧化钠溶液中回收得到较纯净的氢氧化钠固体.
【探究2】回收纯净的氢氧化钠固体.(已知:氢氧化钠溶解度随温度升高增大明显)

请回答下列问题:
(1)试剂X是Ca(OH)2,系列操作z中步骤②的名称是过滤.
(2)探究1中的物质检验和探究2中的除杂提纯都将碳酸钠进行了转化,但二者目的不同,请说明.实验探究1中将碳酸钠转化为氯化钠目的是排除对氢氧化钠检验的干扰实验探究2除杂是为了除去产品中的杂质而将碳酸钠转化为产品氢氧化钠.
20.不属于大气污染物的是( )
| A. | NO2 | B. | SO2 | C. | CO2 | D. | 可吸入颗粒物 |