题目内容
13.现有5.6g不纯的铁与足量的稀硫酸反应生成0.202gH2,则此铁中可能含有的杂质是( )| A. | Cu | B. | C | C. | Mg | D. | Ag |
分析 铜、银在金属活动性顺序中,排在氢的后面,不能和稀硫酸反应;
根据化学方程式计算,可以判断混合物的组成.
解答 解:碳、铜、银不能和稀硫酸反应;
Fe+H2SO4═FeSO4+H2↑
56 2
Mg+H2SO4═MgSO4+H2↑
24 2
由化学方程式可知,每56份质量的铁会生成2份质量的氢气,每24份质量的镁会生成2份质量的氢气,
所以当5.6g纯铁与足量稀硫酸反应时能够生成0.2g氢气,当5.6g纯镁与足量稀硫酸反应时能够生成大于0.2g的氢气,
由此可知,不纯的铁5.6g中,如果含有、碳、铜、银,则生成的氢气小于0.2g,如果含有镁,则生成的氢气大于0.2g,
不纯的铁5.6g与足量的稀硫酸充分反应,生成0.202g氢气,则铁中混有的金属可能是镁.
故选:C.
点评 解答本题要注意临界点,即以5.6g为纯铁时为基础,计算出生成氢气的质量,然后再通过计算判断出杂质是什么物质.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
4.下列能说明铁丝在氧气中燃烧是化学变化的现象是( )
| A. | 银白色铁丝变红 | B. | 放出大量的热 | C. | 生成黑色固体 | D. | 火星四射 |
1.甲、乙、丙、丁四种物质,一定条件下在密闭容器中充分反应,测得反应前后个物质的质量分数如表,下列说法正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前物质质量分数 | 48% | 25% | 10% | 17% |
| 反应后物质质量分数 | 30% | 41% | m | 19% |
| A. | m的值为0 | B. | 该反应的基本类型为分解反应 | ||
| C. | 该反应可能是过氧化氢的分解 | D. | 物质丙一定是该反应的催化剂 |
2.下列说法不正确的是( )
| A. | 活性炭具有吸附性,所以可用于防毒面具 | |
| B. | 金刚石,石墨分子构成不同,所以性质不同 | |
| C. | 将煤块制成蜂窝煤,可以增大反应物的接触面积,使燃烧更充分 | |
| D. | 炼铁的原理是利用一氧化碳与氧化铁反应 |

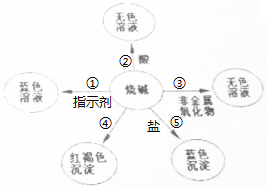 (1)请你在编号①、⑤处各填入一种物质;①是石蕊试液⑤是硫酸铜.
(1)请你在编号①、⑤处各填入一种物质;①是石蕊试液⑤是硫酸铜. 碳元素是组成许多物质的基本元素.
碳元素是组成许多物质的基本元素.