题目内容
10.下列化学方程式书写正确的是( )| A. | 2Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | B. | H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+O2↑ | ||
| C. | Cu+H2SO4=CuSO4+H2↑ | D. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O |
分析 从生成物是否正确、化学式是否正确、化学方程式是否配平、条件标注是否正确、气体沉淀符号是否正确等方面可以判断出本题的答案.
解答 解:A、铁在氧气中燃烧生成四氧化三铁,而不是三氧化二铁,正确的化学方程式为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,因此选项A错误;
B、方程式没有配平,正确的化学方程式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,所以选项B错误;
C、铜与酸不能发生反应,因此选项C错误;
D、原理应用正确,化学式书写正确,方程式也配平了,故D正确.
故选D
点评 在解此类题时,首先检查应用的原理是否正确,然后再根据方程式的书写规则进行检验.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
1.在森林中设防火带的目的是( )
| A. | 隔绝空气 | B. | 降低温度 | C. | 方便运输 | D. | 隔离可燃物 |
18.下列物质中,不属于溶液的是( )
| A. | 矿泉水 | B. | 硬水 | C. | 泥水 | D. | 生理盐水 |
15.X是合成维生素A的原料.物质甲和乙在一定条件下反应可生成物质丙和X,甲、乙和丙的微观示意图见.
(1)X属于化合物(填“单质”或“化合物”).
(2)该反应中甲、乙、丙的质量比为23:17:1,则X中各元素的质量比为m(Na):m(N):m(H)=23:14:2.
| 物质 | 甲 | 乙 | 丙 |  |
| 微观 示意图 |  |  |  |
(2)该反应中甲、乙、丙的质量比为23:17:1,则X中各元素的质量比为m(Na):m(N):m(H)=23:14:2.
2.体操运动员在完成单杠、吊环项目时常用“镁粉”搓手,以起到防滑效果.某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究.
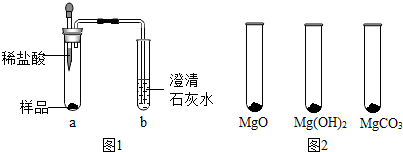
已知:MgO+2HCl═MgCl2+H2O MgCO3+2HCl═MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图1所示进行实验.观察到a试管中有气泡产生,b试管中产生的现象是澄清的石灰水变浑浊.则证明“镁粉”中一定含有MgCO3.
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭.但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成氢氧化钠浓溶液.小明按照修改后的实验方案重复上述实验,观察到b试管口无明显现象,证明“镁粉”中不含Mg.
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验.分别取0.5g三种固体粉末,每次取样方法如图2所示:
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失.在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解.此时消耗稀盐酸的体积约为5.3mL.
【实验分析及结论】“镁粉”不只含有MgCO3.理由是0.5gMgCO3消耗的盐酸体积与0.5g“镁粉”消耗的盐酸体积不相等.
【实验反思】为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5gMgCO3,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL.由此可知“镁粉”中含有MgCO3的质量分数为85%,“镁粉”中除MgCO3外的另一种物质为Mg(OH)2.

已知:MgO+2HCl═MgCl2+H2O MgCO3+2HCl═MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图1所示进行实验.观察到a试管中有气泡产生,b试管中产生的现象是澄清的石灰水变浑浊.则证明“镁粉”中一定含有MgCO3.
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭.但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成氢氧化钠浓溶液.小明按照修改后的实验方案重复上述实验,观察到b试管口无明显现象,证明“镁粉”中不含Mg.
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验.分别取0.5g三种固体粉末,每次取样方法如图2所示:
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失.在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
【实验分析及结论】“镁粉”不只含有MgCO3.理由是0.5gMgCO3消耗的盐酸体积与0.5g“镁粉”消耗的盐酸体积不相等.
【实验反思】为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5gMgCO3,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL.由此可知“镁粉”中含有MgCO3的质量分数为85%,“镁粉”中除MgCO3外的另一种物质为Mg(OH)2.
19.下列有关实验的评价不正确的是( )
| A. | 点燃某可燃物,在火焰上罩一个冷而干燥的烧杯,烧杯的内壁有水雾出现,证明可燃物一定是含有H | |
| B. | 实验室用大理石与盐酸反应制取的CO2通入澄清石灰水无沉淀生成,可能是因为盐酸太浓 | |
| C. | 某混合气体能使灼热的氧化铜变成红色固体,且导出后气体能使澄清石灰水变浑浊,证明原气体中一定含有一氧化碳 | |
| D. | 含二氧化碳、一氧化碳、氢气、水蒸气、氮气的混合气体,依次通过石灰水、灼热的氧化铜、干燥剂碱石灰(假定每步都充分吸收),最后一定只剩下氮气 |
20.下列实验操作或实验数据合确的是( )
| A. | 给烧杯里的物质加热,必须在烧杯底垫上石棉网 | |
| B. | 配制一定量溶液时,可在量筒里进行 | |
| C. | 为加快过滤速度,可用玻璃棒搅拌漏斗中的液体 | |
| D. | 用普通温度计测得某液体的温度为25.62℃ |