��Ŀ����
10��ijʵ��С��Ϊ̽����Ļ�ѧ���ʣ��ɼס���ͬѧ��Ʋ��������ͼ��ʾ��ʵ�飮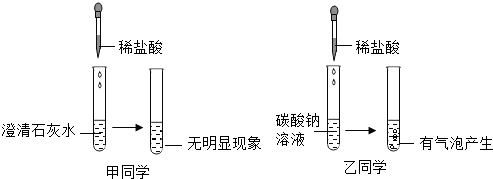
��1����ͬѧʵ�����������Ļ�ѧ����ʽΪCa��OH��2+2HCl=CaCl2+2H2O��
���������ϡ�CaCl2��NaCl����Һ�����ԣ�Na2CO3��Һ�ʼ��ᡱ����ԣ�
��ʵ��̽��һ��ȷ���ס���ͬѧ����ʵ���������Һ�е����ʣ�
��2��ȡ��������Һ����������ʯ����Һ����Һ�Ժ�ɫ����������Һ��һ�����е�������CaCl2��HCl��д��ѧʽ����
��3��ȡ��������Һ�����������̪��Һ����Һ�Ժ�ɫ����������Һ��һ�����е�������NaCl��Na2CO3��д��ѧʽ����
��ʵ��̽������
��4���ס���ͬѧ������ʵ��������Һ����ͬһ��Һ���У��۲쵽��Һ���в����������ݣ������а�ɫ�������ɣ��ð�ɫ������CaCO3��д��ѧʽ����
�����۽�������ͬѧ��������������ϸ�������ȡ�������ˣ�������Һ�к�����Щ�����أ��������۴��һ����Ϊ��һ������NaCl�����ܺ���CaCl2�������Na2CO3�еIJ������ʣ�
��ʵ��̽������ȡ������Һ���Թ��У��μӹ�����ϡ���ᣬ�ɹ۲쵽�д������ݲ�����
�������ܽ����Һ�к��е��������Ȼ��ƺ�Na2CO3��д��ѧʽ����
��̽������չ����һ����Na2SO4��NaCl����������ɵĹ�����Ʒ��Ϊȷ������ɣ�����С��ͬѧ����Ʒȫ����������ˮ���Ƴ�119.3g��Һ���������м���104gBaCl2��Һ������ǡ����ȫ��Ӧ�����ˣ��õ�23.3g��ɫ������һ����������Һ�����ⶨ������Һ��������������Ϊ9%���Լ��㣺�����������̣�
��5������BaCl2����Һ�����ʵ�����������
��6��������Ʒ��������
���� ���ݼ�ͬѧʵ���ʵ������������ʵijɷ֣�
���ݳ���������������Ƶ�������Ȼ����������Ȼ��Ƶ��������ٸ���������Һ���������������ԭ����������NaCl�������������ԭ����������NaCl������������
��� �⣺��1����ͬѧʵ��������������ϡ����ķ�Ӧ��Na2CO3��Һ�Լ��ԣ�
��2��ȡ��������Һ����������ʯ����Һ����Һ�Ժ�ɫ��˵����Һ�����ԣ����Լ�������Һ��һ�����е�����CaCl2��HCl��
��3��ȡ��������Һ�����������̪��Һ����Һ�Ժ�ɫ��˵����Һ�Լ��ԣ�������������Һ��һ�����е�����NaCl��Na2CO3��
��4���ס���ͬѧ������ʵ��������Һ����ͬһ��Һ���У������Ļ�ѧ��Ӧ��Na2CO3+2HCl=2NaCl+H2O+CO2����Na2CO3+CaCl2=CaCO3��+2NaCl������ɫ������CaCO3��
�������ܽȡ������Һ���Թ��У��μӹ�����ϡ���ᣬ�ɹ۲쵽�д������ݲ�����˵����̼���ƣ�����Һ�к��е��������Ȼ��ƺ�̼���ƣ�
�⣺������BaCl2����Һ�����ʵ�����Ϊx����ԭ������������Ƶ�����Ϊz�������Ȼ��Ƶ�����Ϊy��
Na2SO4+BaCl2=BaSO4��+2NaCl
142 208 233 117
z x 23.3g y
$\frac{208}{x}=\frac{233}{23.3g}$
x=20.8g
$\frac{233}{23.3g}=\frac{117}{y}$
y=11.7g
$\frac{233}{23.3g}=\frac{142}{z}$
z=14.2g
��5������BaCl2����Һ�����ʵ���������$\frac{20.8g}{104g}��100%$=20%��
��6��������Ʒ������ΪW����$\frac{W-14.2g+11.7g}{119.3g+104g-23.3g}$��100%=9%
����W=20.5g
�ʴ�Ϊ����1��Ca��OH��2+2HCl=CaCl2+2H2O�����ԣ���2��CaCl2��HCl��
��3��NaCl��Na2CO3����4��CaCO3��Na2CO3����5��20%����6��20.5g��
���� ������������ͻ�Ƶ㣺һ�Ǹ��ݸ��ֽⷴӦ�������ж�����Щ�����ڷ�����Ӧ�������漰���йػ�ѧʽ�ļ��㣮

| ѡ�� | �������ʵ | �� �� |
| A | ���ʯ��ʯī���������ʲ���ϴ� | ̼ԭ�����з�ʽ��ͬ |
| B | �������� | ��Ϊ�����ڲ�ͣ�˶� |
| C | ���Ͳ���������֢ | ��Ϊ������ȱ����Ԫ�� |
| D | �ø��������� | ���ý����ĵ����� |
| A�� | A | B�� | B | C�� | C | D�� | D |
| A�� |  �ײ� | B�� |  �㽶 | C�� |  ���� | D�� |  �ƹ� |
| A�� | 3 | B�� | 17 | C�� | 20 | D�� | 37 |
 ��ͼ��a��b��c�������ʵ��ܽ�����ߣ�a��c���ܽ�������ཻ��P�㣮��ͼ�ش�
��ͼ��a��b��c�������ʵ��ܽ�����ߣ�a��c���ܽ�������ཻ��P�㣮��ͼ�ش�