题目内容
19.将5.50g铁、铝混合粉末加入200g20%的稀硫酸中,充分反应后,得到质量为ag的气体.(1)硫酸是否过量是(填“是”或“否”),判断理由是无论5.50g按照什么比例混合都不会消耗那么多的硫酸.
(2)若a=0.4g,则混合物中铁的质量分数为51%.
(3)另有由铁、铝任意质量比组成的混合物mg,溶于足量稀硫酸中,则产生气体的质量x取值范围为$\frac{m}{28}$≤x≤$\frac{m}{9}$.
分析 根据铁和硫酸、铝与硫酸的反应计算分析
(1)假设5.50g物质分别为纯铁和纯铝分别计算需要的硫酸的量,和给定硫酸中的溶质的量对比即可;
(2)当a=0.4g时,设定铁铝质量计算即可;
(3)假设mg分别为纯铁和纯铝,计算氢气,得出取值范围.
解答 解:(1)200g20%的稀硫酸中溶质的质量为200g×20%=40g.
设5.50g的金属为纯铁,则对应的硫酸的质量为x.
Fe+H2SO4=FeSO4+H2↑
56 98
5.50g x
$\frac{56}{98}$=$\frac{5.50g}{x}$
x=9.625g
设5.50g的金属为纯铝,则对应的硫酸的质量为y.
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 294
5.50g y
$\frac{54}{294}$=$\frac{5.50g}{y}$
y≈29.9g
两者均小于给定的40g,所以硫酸过量.
(2)当a=0.4g氢气时,由于酸已经确定过量,金属要完全反应,则设铁的质量为x,铁对应的氢气的质量为y.则铝的质量为5.50g-x,对应的氢气质量为0.4g-y.
Fe+H2SO4=FeSO4+H2↑
56 2
x y
$\frac{56}{2}$=$\frac{x}{y}$
x=28y
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 6
5.50g-x 0.4g-y
$\frac{54}{6}$=$\frac{5.50g-x}{0.4g-y}$
5.50g-x=(0.4g-y)×9
把x=28y带入,y=0.1 x=2.8
即铁的质量为2.8g,则对应的混合物中的铁的质量分数为$\frac{2.8g}{5.50g}$×100%≈51%.
(3)设铁质量为mg,溶于足量稀硫酸中,产生气体的质量x.
Fe+H2SO4=FeSO4+H2↑
56 2
mg x
$\frac{56}{2}$=$\frac{mg}{x}$
x=$\frac{m}{28}g$
设铝质量为mg,溶于足量稀硫酸中,产生气体的质量x.
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 6
mg x
$\frac{54}{6}$=$\frac{mg}{x}$
x=$\frac{m}{9}$g
所以氢气的质量x大于或者$\frac{m}{28}$,小于或者$\frac{m}{9}$
即$\frac{m}{28}$≤x≤$\frac{m}{9}$
故答案为:(1)是 无论5.50g按照什么比例混合都不会消耗那么多的硫酸.
(2)51%.
(3)$\frac{m}{28}$≤x≤$\frac{m}{9}$.
点评 根据给定条件逐一分析计算即可,不要试图想什么技巧,一步步逐一突破.(本题不建议大家浪费时间思考,意义不大)

| A. | 空气中分离出的氮气化学性质不活泼,可作食品保护气 | |
| B. | 空气主要是由氧气和氮气组成,其中氧气的质量约占空气质量的$\frac{1}{5}$ | |
| C. | 空气中的氧气、二氧化碳通过光合作用达到循环 | |
| D. | 工业上分离液态空气制氧气的过程属于物理变化 |
| A. | ①②⑤ | B. | ①③ | C. | ④⑤⑥ | D. | ③⑤ |
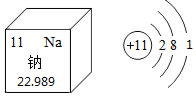
| A. | 钠原子有11个中子 | B. | 钠离子核外有3个电子层 | ||
| C. | 钠的相对原子质量为22.989 | D. | 化学反应中,钠原子失去电子 |




