��Ŀ����
7�� ij��ȤС�齫NaOH��Һ��Na2CO3��Һ��ϣ�����������
ij��ȤС�齫NaOH��Һ��Na2CO3��Һ��ϣ�������������������⡿���������Ƿ�����ѧ��Ӧ��
���ռ����ϡ�
�ٲ������ϣ�NaHCO3+NaOH�TNa2CO3+H2O
����һ�����ʵ�����������NaHCO3��NaOH��Na2CO3������Һ��������ʵ�飬Ϊ���ʵ�鷽���ṩ�ο���
| NaHCO3��Һ | NaOH��Һ | Na2CO3��Һ | |
| ����ϡ���� | ����� | �����Ա仯 | �������� |
| �������ʯ��ˮ | ��Һ����� | �����Ա仯 | ����� |
| ���� �Ȼ�����Һ | �����Ա仯 | ��Һ����� | ��Һ����� |
| ������Һ�����ڣ��� ����ͨ�����ʯ��ˮ | ����ʯ��ˮ ����� | �����Ա仯 | �����Ա仯 |
��ʵ��̽����֤��NaOH��Һ��NaHCO3��Һ��Ӧ������Na2CO3��
С��ѡ���ϱ�ʵ���е�ҩƷ���������ͼ1��ʾʵ�飬����NaHCO3��Һ�м���A��Һ�������������ٵμ�NaOH��Һ����Һ����ǣ���A��Һ��CaCl2��
���������ɡ����ʵ�鲻����֤����Na2CO3���ɣ���������Ca��OH��2����ˮ����ҺҲ�����ǣ�Ϊ��֤����Na2CO3���ɣ���Ҫȡ������������������ϡHCl��������ɫ���壬֤����Na2CO3��
�������о���NaOH��Һ��NaHCO3��Һ��Ӧ����Һ�����ʵijɷ�
��������衿���ʿ����ǣ������Na2CO3�������NaOH��NaHCO3�����Na2CO3��NaOH
��ʵ���¼��
| ��� | ʵ����� | ���� | ���� |
| 1 | ȡ������Ӧ�����Һ���������ڣ�������ͨ������ʯ��ˮ | ����ʯ��ˮ������� | ���� ���� |
| 2 | ȡ������Ӧ�����Һ��������CaCl2��Һ�����ˣ�����Һ�м��� ��̪ | ��Һ��� | �������� |
С������ȡ��Ӧ�����Һ70.4g���ձ��У���μ���10%��ϡ���ᣮʵ������м���ϡ��������������������ϵ��ͼ2��ʾ������ǡ����ȫ��Ӧʱ��Һ�����ʵ�������������д��������̣�
���� ���ռ����ϡ���
�����ϡ������������Ʒ�Ӧ�����Ȼ��ƺ�ˮ��
���������ƺ�̼���Ʒ�Ӧ�����������ƺ�̼��ƽ��н��
��ʵ��̽�����۲�ͼ��������̼�����ƺ��Ȼ��Ʒ�Ӧ������������Ȼ������������Ʒ�Ӧ���ɲ�������н��
���������ɡ�����Ca��OH��2����ˮ����ҺҲ�����ǣ�����Na2CO3��������ϡHCl��Ӧ������ɫ���壮
��������衿�����о�NaOH��Һ��NaHCO3��Һ��Ӧ����Һ�����ʵijɷ����ʣ����ݲ����Ͳ�����Ʋ�����Na2CO3��NaOH��
��ʵ���¼�����ݡ�NaHCO3+NaOH�TNa2CO3+H2O���ͷ�̪�ı�ɫ���ɣ����з�����
�����ݷ�����������������������ʽ�ı���������������ʵ�������Ȼ�����̼���ƺ����ᷴӦ�����Ȼ��ơ�ˮ���Ͷ�����̼�ķ�Ӧ�Ļ�ѧ����ʽ������ɵ��Ȼ��Ƶ������Ͷ�����̼��������������Һ�е����ʰ���ԭ�����Ȼ��ƺ����ɵ��Ȼ��ƣ��ٸ��������غ㶨���ձ��з�Ӧǰ���ʵ�������ȥ���ɵĶ�����̼���������Ƿ�Ӧ��������Һ�������������Ȼ��Ƶ���������������Һ����������������Һ����������������
��� �⣺
���ռ����ϡ���
��ϡ�����̼�����Ʒ�Ӧ�����Ȼ��ƺ�ˮ�����Է�Ӧ��ѧ����ʽΪ��HCl+NaOH�TNaCl+H20��
���������ƺ�̼���Ʒ�Ӧ�����������ƺ�̼��ƣ���Ӧ������Ϊ����Һ����ǣ�
��2��
��ʵ��1���ɱ�֪��̼�����ƺ��Ȼ��Ʒ�Ӧ�������������������ƣ�̼���������������Ʒ�Ӧ����̼���ƣ�̼�������Ȼ��Ʒ�Ӧ���ɳ��������ɱ�֪���Ȼ������������Ʒ�Ӧ�����������ƣ������������������Һ��Ҳ����������Ϊ֤����Һ�������ɵ�̼���ƣ����Լ���������ϡ���ᣬ�������ݲ��������У������ޣ��ʴ�Ϊ��CaCl2��CaCl2��NaOH��Ӧ����Ca��OH��2�������������������Һ��Ҳ����������ȡ������Ӧ����������������ϡ���ᣬ��������ɫ����֤����Na2CO3���ɣ���֮��û�У�
��ʵ��̽�����۲�ͼ��������̼�����ƺ��Ȼ��Ʒ�Ӧ������������Ȼ������������Ʒ�Ӧ���ɲ������A��Һ��CaCl2��
���������ɡ����� Ca��OH��2����ˮ����ҺҲ�����ǣ�����Na2CO3�������� ϡHCl��Ӧ������ɫ���壬��ʵ�鲻����֤����Na2CO3���ɣ���������Ca��OH��2����ˮ����ҺҲ�����ǣ�Ϊ��֤����Na2CO3���ɣ���Ҫȡ������������������ϡHCl��������ɫ���壬֤����Na2CO3��
��������衿�����о�NaOH��Һ��NaHCO3��Һ��Ӧ����Һ�����ʵijɷ����ʣ����ݲ����Ͳ�����Ʋ�����Na2CO3��NaOH��
��ʵ���¼�����ݡ�NaHCO3+NaOH�TNa2CO3+H2O���ͷ�̪�ı�ɫ���ɣ���
| ��� | ʵ����� | ���� | ���� |
| 1 | ȡ������Ӧ�����Һ���������ڣ�������ͨ������ʯ��ˮ | ����ʯ��ˮ������� | ���� ���� |
| 2 | ȡ������Ӧ�����Һ��������CaCl2��Һ�����ˣ�����Һ�м��� ��̪ | ��Һ��� | �������� |
�⣺����̼���Ʒ�Ӧ�����������Ϊx��ͬʱ�����Ȼ��Ƶ�����Ϊy
Na2CO3+2HCl=2NaCl+H2O+CO2��
73 117 44
x��10% y 4.4g
��$\frac{73}{x��10%}=\frac{117}{y}=\frac{44}{4.4g}$����ã�x=73g��y=11.7g
���������������ᷴӦ�����Ȼ��Ƶ�����Ϊz��
NaOH+HCl=NaCl+H2O
36.5 58.5
�� 109.5g-73g����10% z
$\frac{36.5}{58.5}=\frac{��109.5g-73g����10%}{z}$����ã�z=5.85g
��Ӧ����Һ�����ʵ�����=11.7g+5.85g=17.55g
��Ӧ����Һ������=70.4g+109.5g-4.4g=175.5g
��Ӧ����Һ�����ʵ���������=$\frac{17.55g}{175.5g}��$100%=10%
��ǡ����ȫ��Ӧʱ��Һ�����ʵ���������Ϊ10%��
��������
�⣺���������غ㣬��Ӧǰ��������Ԫ�ص��������ڷ�Ӧ���Ȼ�������Ԫ�ص�������
�跴Ӧ�������Ȼ��Ƶ�����Ϊx��
HCl��NaCl
36.5 58.5
109.5g��10% x
$\frac{36.5}{109.5g��10%}=\frac{58.5}{x}$����ã�x=17.55g
��Ӧ����Һ������=70.4g+109.5g-4.4g=175.5g
��Ӧ����Һ�����ʵ����������T$\frac{17.55g}{175.5g}��$100%=10%
��ǡ����ȫ��Ӧʱ��Һ�����ʵ���������Ϊ10%��
�ʴ�Ϊ��
���ռ����ϡ��������ݣ� Na2CO3+Ca��OH��2=CaCO3��+2NaOH
��ʵ��̽����CaCl2��
���������ɡ�Ca��OH��2����ˮ����ҺҲ�����ǣ� ϡHCl��
��������衿Na2CO3��NaOH��
��ʵ���¼����̪��
�����ݷ�����10%��
���� ���⿼��ѧ�����ͼ������������������ۺ�����������ʱע����Һ�е����ʲ�����ֻ��̼���ƺ�ϡ���ᷴӦ���ɵĻ���ԭ�������еģ�������Һ���������������غ���㣮�����ϸ�ģ���ϸ�۲�ͼ���������Щ��Ϣ���Է�����Ӧ���ܵõ�һЩ��ʾ��

 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д�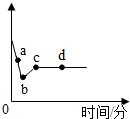 ��һ������AgNO3��Cu��NO3��2�Ļ����Һ�м���һ������Zn�ۣ���Һ�����淴Ӧʱ��仯�������ͼ��ʾ������˵����ȷ���ǣ�������
��һ������AgNO3��Cu��NO3��2�Ļ����Һ�м���һ������Zn�ۣ���Һ�����淴Ӧʱ��仯�������ͼ��ʾ������˵����ȷ���ǣ�������| A�� | ȡa����Һ���μ�ϡ���ᣬ�ް�ɫ���� | |
| B�� | c����Һ������ΪZn��NO3��2 | |
| C�� | ��ȡb��c�ι��壬�μ�ϡ���ᣬ�����ݲ��� | |
| D�� | ȡd��Ĺ�����2�� |
| A�� | ����������ȼ�շ�������ɫ���� | |
| B�� | ��ֹ������ʴ�DZ���������Դ����Ч;�� | |
| C�� | ϴ�ྫ�����黯���ã���ȥ���;��ϵ����� | |
| D�� | ����ʹ�õ�Ǧ��о���ý����Ƴɵ� |
| A�� | A��+4 | B�� | +5 | C�� | +6 | D�� | +7 |
| A�� |  | B�� |  | C�� |  | D�� |  |
 A��B��C��D�dz��л�ѧ���������ʣ��ܷ�����ͼ��ʾ��ת����ϵ��
A��B��C��D�dz��л�ѧ���������ʣ��ܷ�����ͼ��ʾ��ת����ϵ��
 ������ͼ��ʾװ�ã�����K1��K2�ǵ��ɼУ�����֤������̼�����ʣ�
������ͼ��ʾװ�ã�����K1��K2�ǵ��ɼУ�����֤������̼�����ʣ�