题目内容
15.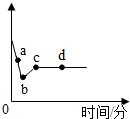 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入一定量的Zn粉,溶液质量随反应时间变化的情况如图所示.下列说法正确的是( )
向一定质量AgNO3和Cu(NO3)2的混合溶液中加入一定量的Zn粉,溶液质量随反应时间变化的情况如图所示.下列说法正确的是( )| A. | 取a点溶液,滴加稀盐酸,无白色沉淀 | |
| B. | c点溶液中溶质为Zn(NO3)2 | |
| C. | 若取b~c段固体,滴加稀盐酸,无气泡产生 | |
| D. | 取d点的固体有2种 |
分析 根据金属与盐溶液的反应进行分析,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,且置换时先把最弱的金属置换出来,并通过各反应的关系进行溶液质量的变化分析.
解答 解:在金属活动性顺序中,Zn>Cu>Ag,向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,与两种溶质依次发生反应
Zn+2AgNO3=Zn(NO3)2+2Ag
65 216
所以析出银的过程是溶液质量减少的过程;
Zn+Cu(NO3)2=Zn(NO3)2+Cu
65 64
所以析出铜的过程是溶液质量增加的过程
A、在a点时,硝酸银没有全部参加反应,溶液中含有硝酸银,滴加稀盐酸,会生成白色沉淀,故A错误;
B、c点时硝酸铜恰好完全反应,溶液中只有硝酸锌,故B正确;
C、b~c段是硝酸银全部参加反应完后锌和硝酸铜反应的过程,固体为银和铜,滴加稀盐酸,无气泡产生,故C正确;
D、d点时锌过量,因此固体为银、铜、锌3种,故D错误;
故选BC.
点评 本题考查了金属活动性顺序的应用,要求学生熟悉金属的活动性顺序表,能利用活动性判断反应的发生,还要结合坐标分析各段的意义.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
5.某化学兴趣小组的同学为了探究“复分解反应发生的条件”,做了两个实验:CuSO4溶液分别与NaOH溶液、BaCl2溶液反应.实验结束后将两实验中的废液倒入同一个干净的烧杯中,充分混合后过滤,得到滤液呈无色.
(1)写出废液混合后使滤液变无色时一定发生的反应的化学方程式:CuCl2+2NaOH=Cu(OH)2↓+2 NaCl.
(2)用pH试纸测定滤液的 pH=7.
(3)该小组的同学对滤液中溶质的成分继续进行了如下探究实验:
【提出问题】滤液中溶质的成分是什么?
【作出猜想】猜想Ⅰ:NaCl;猜想ⅡNaCl、BaCl2;猜想ⅢNaCl、Na2SO4.
【实验探究】
【交流拓展】要使蓝色溶液变成无色,还可以用不同于上述原理的方法,即在蓝色溶液中加入足量的锌.
(1)写出废液混合后使滤液变无色时一定发生的反应的化学方程式:CuCl2+2NaOH=Cu(OH)2↓+2 NaCl.
(2)用pH试纸测定滤液的 pH=7.
(3)该小组的同学对滤液中溶质的成分继续进行了如下探究实验:
【提出问题】滤液中溶质的成分是什么?
【作出猜想】猜想Ⅰ:NaCl;猜想ⅡNaCl、BaCl2;猜想ⅢNaCl、Na2SO4.
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| 实验①:取少量滤液于试管中,加入适量的纯碱溶液,振荡. | 无明显现象 | 猜想Ⅱ不成立 |
| 实验②取少量滤液于试管中,滴加适量的BaCl2溶液(写溶质的化学式),振荡. | 产生白色沉淀 | 猜想Ⅲ成立 |
6.为增强农作物的抗倒伏能力,需施加钾肥.下列化肥中,应该施用的是( )
| A. | K2CO3 | B. | NH4NO3 | C. | Ca(H2PO4)2 | D. | NH4HCO3 |
20.下列化学实验操作正确的是( )
| A. |  制取氢气 | B. |  给溶液加热 | C. |  稀释浓硫酸 | D. |  熄灭酒精灯 |
7. 某兴趣小组将NaOH溶液和Na2CO3溶液混合,无明显现象
某兴趣小组将NaOH溶液和Na2CO3溶液混合,无明显现象
【提出问题】两种物质是否发生化学反应?
【收集资料】
①查阅资料:NaHCO3+NaOH═Na2CO3+H2O
②用一定溶质的质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考.
表中的现象Ⅰ为产生气泡,现象Ⅱ对应反应的化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
【实验探究】证明NaOH溶液和NaHCO3溶液反应生成了Na2CO3.
小明选用上表实验中的药品,设计了如图1所示实验,先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是CaCl2.
【交流质疑】这个实验不足以证明有Na2CO3生成,其理由是Ca(OH)2微溶于水,溶液也会变浑浊.为了证明有Na2CO3生成,需要取少量滤渣加入足量的稀HCl,产生无色气体,证明有Na2CO3.
【继续研究】NaOH溶液和NaHCO3溶液反应后溶液中溶质的成分
【猜想假设】溶质可能是:猜想ⅠNa2CO3.猜想ⅡNaOH和NaHCO3猜想ⅢNa2CO3和NaOH
【实验记录】
【数据分析】
小明继续取反应后的溶液70.4g于烧杯中,逐滴加入10%的稀盐酸.实验过程中加入稀盐酸与产生气体的质量关系如图2所示.计算恰好完全反应时溶液中溶质的质量分数.(写出计算过程)
 某兴趣小组将NaOH溶液和Na2CO3溶液混合,无明显现象
某兴趣小组将NaOH溶液和Na2CO3溶液混合,无明显现象【提出问题】两种物质是否发生化学反应?
【收集资料】
①查阅资料:NaHCO3+NaOH═Na2CO3+H2O
②用一定溶质的质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考.
| NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
| 加入稀盐酸 | 现象Ⅰ | 无明显变化 | 产生气泡 |
| 加入澄清石灰水 | 溶液变浑浊 | 无明显变化 | 现象Ⅱ |
| 加入 氯化钙溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 无明显变化 | 无明显变化 |
【实验探究】证明NaOH溶液和NaHCO3溶液反应生成了Na2CO3.
小明选用上表实验中的药品,设计了如图1所示实验,先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是CaCl2.
【交流质疑】这个实验不足以证明有Na2CO3生成,其理由是Ca(OH)2微溶于水,溶液也会变浑浊.为了证明有Na2CO3生成,需要取少量滤渣加入足量的稀HCl,产生无色气体,证明有Na2CO3.
【继续研究】NaOH溶液和NaHCO3溶液反应后溶液中溶质的成分
【猜想假设】溶质可能是:猜想ⅠNa2CO3.猜想ⅡNaOH和NaHCO3猜想ⅢNa2CO3和NaOH
【实验记录】
| 序号 | 实验操作 | 现象 | 结论 |
| 1 | 取少量反应后的溶液加热至沸腾,茎气体通过澄清石灰水 | 澄清石灰水不变浑浊 | 猜想 Ⅱ不成立 |
| 2 | 取少量反应后的溶液加入足量CaCl2溶液,过滤,向溶液中加入 酚酞 | 溶液变红 | 猜想Ⅲ成立 |
小明继续取反应后的溶液70.4g于烧杯中,逐滴加入10%的稀盐酸.实验过程中加入稀盐酸与产生气体的质量关系如图2所示.计算恰好完全反应时溶液中溶质的质量分数.(写出计算过程)
4.如图所示操作中,正确的是( )
| A. |  稀释浓硫酸 | B. |  蒸发溶液 | C. |  称量固体质量 称量固体质量 | D. |  测溶液的pH |

