题目内容
12.科学兴趣小组的同学对混合均匀的氧化铜和铜粉末中单质铜含量进行测定,二组同学各取10克粉末样品置于烧杯中,然后加入溶质质量分数相同的稀硫酸,充分反应后,对烧杯中剩余固体进行称量,实验数据记录如下:| 组别编号 | 样品质量(克) | 加入稀硫酸质量(克) | 剩余固体质量(克) |
| 1 | 10 | 20 | 8.4 |
| 2 | 10 | 30 | 8 |
(2)样品中单质的质量分数为80%;
(3)加入的稀硫酸溶质质量分数使多少?(写出计算过程)
分析 (1)分析题意可知:铜和氧化铜只有氧化铜和硫酸反应,第一次硫酸完全反应,固体减少的质量为(10g-8.4g)=1.6g,第二次加入硫酸固体的质量还会减少,说明剩余的固体含有铜和氧化铜.第二次硫酸有剩余,固体减少的质量为(8.4g-8g)=0.4g,说明硫酸有剩余,氧化铜全部反应.
(2)第二次剩余固体质量即为铜的质量,进一步计算铜的质量分数.
(3)根据铜的质量可求氧化铜的质量,结合方程式计算硫酸的质量,进一步计算稀硫酸溶质质量分数.
解答 解:(1)由题目给出的信息可知:铜和氧化铜只有氧化铜和硫酸反应,第一次硫酸完全反应,固体减少的质量为(10g-8.4g)=1.6g,第二次加入硫酸固体的质量还会减少,说明剩余的固体含有铜和氧化铜.第二次硫酸有剩余,固体减少的质量为(8.4g-8g)=0.4g,说明硫酸有剩余,氧化铜全部反应,剩余的固体只有铜.故答案为:铜和氧化铜(Cu和CuO);
(2)有题目给出的信息可知铜的质量是8g,铜的质量分数=$\frac{8g}{10g}$×100%=80%,故答案为:80%;
(3)由表格信息可知:第一次硫酸完全反应,第二次硫酸有剩余,因此需要用第一次的数据.
设硫酸的质量为x
CuO+H2SO4=CuSO4+H2O
80 98
10g-8.4g x
$\frac{80}{10g-8.4g}=\frac{98}{x}$
x=1.96g
硫酸的质量分数=$\frac{1.96g}{20g}$×100%=9.8%
答:稀硫酸溶质质量分数是9.8%.
点评 本考点是有关化学方程式的计算题,属于表格型计算题.近几年的中考计算题,题型多样,主要有表格题、图象题、标签题、图象和表格相联系的综合题以及与文字叙述题等,从不同的方面考查了学生的识图能力、分析能力和计算能力.同学们要认真把握.

| A. | 复合氧化物中Cu的化合价为+1和+2价 | |
| B. | 复合氧化物中Cu的化合价为+2和+3价 | |
| C. | 复合氧化物中+2价的Cu占铜的总量三分之一 | |
| D. | 复合氧化物中+3价的Cu占铜的总量三分之二 |
| A. | Ca2+:表示钙离子显+2价 | |
| B. | H2O:表示说明水中有1个氢分子 | |
| C. | $\stackrel{+2}{Fe}$Cl2中正上方的“+2”:表示氯化铁中铁显+2价 | |
| D. | 2N2O中的系数“2”:表示2个一氧化二氮分子 |
| A. | 石油分馏出汽油、柴油 | B. | 将冰块制成冰雕 | ||
| C. | 铁矿石冶炼成生铁 | D. | 工业上从空气中分离出氧气 |

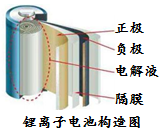 阅读下面科普短文.
阅读下面科普短文.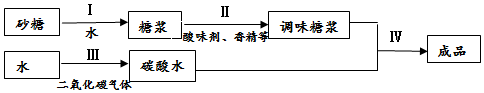

 表示S2-.
表示S2-.