题目内容
1.如图实验操作正确的是( )| A. |  稀释浓硫酸 | B. |  向试管中加入锌粒 | ||
| C. |  加热液体 | D. |  向试管内倾倒液体 |
分析 A、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅)进行分析判断.
B、根据向试管中装块状或颗粒状固体药品的方法进行分析判断.
C、根据给试管中的液体加热的方法进行分析判断.
D、根据向试管中倾倒液体药品的方法进行分析判断.
解答 解:A、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;并能在量筒中稀释浓硫酸,图中所示操作错误.
B、向试管中装锌粒时,先将试管横放,用镊子把锌粒放在试管口,再慢慢将试管竖立起来,图中所示操作错误.
C、给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的$\frac{1}{3}$,图中没有用外焰加热、试管没有倾斜,图中所示操作错误.
D、向试管中倾倒液体药品时,瓶塞要倒放,标签要对准手心,瓶口紧挨;图中瓶口没有紧挨、瓶塞没有倒放、标签没有向着手心,所示操作正确.
故选:D.
点评 本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
12.下列实验方案设计不合理的是( )
| 选项 | 实验目的 | 方案 |
| A | 鉴别硝酸钠溶液和氢氧化钾溶液 | 取样,滴加MgCl2溶液,观察现象 |
| B | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、过滤、蒸发 |
| C | 除去KCl中的KClO3 | 加入MnO2后再加热到固体质量不变 |
| D | 检验氢气的纯度 | 收集一试管气体靠近明火移开拇指点燃,听声音 |
| A. | A | B. | B | C. | C | D. | D |
9.下列一步完成的除杂方案(括号中为杂质)中,正确的是( )
| A. | CO2(CO)--点燃 | B. | CO2(HCl)--通过足量的氢氧化钠溶液 | ||
| C. | CaO(CaCO3)--高温充分煅烧 | D. | HCl溶液(CaCl2)--加过量的氧化钙 |
6.工业上常利用铝热反应冶炼金属锰,反应原理为:3MnO2+4Al$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3,其中被还原的物质是
( )
( )
| A. | Mn | B. | Al | C. | MnO2 | D. | Al2O3 |
13.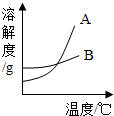 运用溶解度表与溶解度曲线图回答下列问题:
运用溶解度表与溶解度曲线图回答下列问题:
(1)图中表示氯化钠溶解度曲线的是B(填字母序号).
(2)在溶解度曲线图中找出表示A、B两种物质在某温度下溶解度相等的点,用P点标注在图上,并注明此时的温度和溶解度数值.
(3)40℃时,100g水中加入40gA物质,所得溶液是不饱和(填“饱和”或“不饱和”)溶液.
(4)生活在盐湖边的人们习惯“冬捞碱,夏晒盐”,请解释“冬捞碱”的原理是碳酸钠的溶解度受温度影响大,冬天温度低,碳酸钠溶解度变小,易结晶析出.
 运用溶解度表与溶解度曲线图回答下列问题:
运用溶解度表与溶解度曲线图回答下列问题:| 温度/°C | 0 | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35 | 35.5 | 36 | 36.5 | 37 |
| 碳酸钠 | 6 | 10 | 18 | 36.5 | 50 | |
(2)在溶解度曲线图中找出表示A、B两种物质在某温度下溶解度相等的点,用P点标注在图上,并注明此时的温度和溶解度数值.
(3)40℃时,100g水中加入40gA物质,所得溶液是不饱和(填“饱和”或“不饱和”)溶液.
(4)生活在盐湖边的人们习惯“冬捞碱,夏晒盐”,请解释“冬捞碱”的原理是碳酸钠的溶解度受温度影响大,冬天温度低,碳酸钠溶解度变小,易结晶析出.
10.下列现象属于分子运动的是( )
| A. | 黄沙漫天 | B. | 花香四溢 | C. | 尘土飞扬 | D. | 大雪纷飞 |
11.以下不会对内陆河水,湖水造成污染的是( )
| A. | 工厂企业污水的超标排放 | B. | 生活中大量使用含磷洗衣粉 | ||
| C. | 渔民放养鱼虾 | D. | 农田任意施用农药,化肥 |