题目内容
5.实验室有一瓶硫酸溶液,老师请小红同学通过实验测定该废液中硫酸的质量分数,小红同学取一洁净小烧杯并称其质量,向其中倒入少量硫酸废液后继续称量,然后将一枚称量过的铁钉(已用砂纸除去铁锈)放入烧杯中,充分反应后铁钉剩余,再次称量,记录数据如下:| 物品 | 烧杯 | 烧杯+硫酸废液 | 铁钉 | 反应前后质量 |
| 质量/g | 43.2 | 63.2 | 30.8 | 73.9 |
(1)反应产生的气体的质量:0.1g;
(2)金属废液中硫酸的溶质质量分数;
(3)如果铁钉的铁锈未除净,对判定结果的影响是偏小(填“偏大”、“偏小”或“无影响”).
分析 (1)铁和稀硫酸反应生成硫酸亚铁和氢气,根据质量差可以求生成氢气的质量;
(2)根据氢气的质量求出硫酸中溶质的质量,从而求出废液中硫酸的质量分数即可;
(3)根据铁钉的铁锈未除净,则铁锈消耗一部分硫酸进行解答
解答 解:(1)完全反应后,容器中的物质的质量差,就是生成氢气的质量,氢气的质量为:63.2g+30.8g-73.9g=0.1g;
(2)解:设参加反应硫酸的质量为x
Fe+H2SO4═FeSO4+H2↑
98 2
X 0.1g
$\frac{98}{X}=\frac{2}{0.1g}$
X=4.9g
硫酸的质量分数为$\frac{4.9g}{63.2g-43.2g}$×100%=24.5%
答:废液中硫酸的质量分数是24.5%.
(3)如果铁钉的铁锈未除净,则铁锈消耗一部分硫酸,氧化铁和硫酸反应生成硫酸铁和水,反应方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;根据氢气求出的硫酸质量就偏小,从而使计算出的硫酸的质量分数偏小.
答案:(1)0.1g;
(2)24.5%;
(3)偏小.
点评 本题主要考查化学方程式的书写和有关化学方程式的计算,难度较小,书写化学方程式时要注意四步,一是反应物和生成物的化学式要正确,二是遵循质量守恒定律,三是写上必要的条件,四是看是否有“↑”或“↓”.

练习册系列答案
相关题目
15.下列分类正确的是( )
| A. | 复合肥料:硝酸钾、过磷酸钙、磷酸二氢铵 | |
| B. | 合成材料:塑料、天然橡胶、合成纤维 | |
| C. | 有机物:甲烷、乙醇、葡萄糖 | |
| D. | 碱类:纯碱、烧碱、熟石灰 |
13.如图是某反应的微观示意图,下列说法不正确的是( )
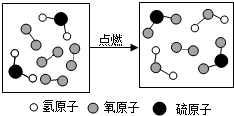

| A. | 反应物中有单质 | B. | 该反应为置换反应 | ||
| C. | 生成物的分子个数比为1:1 | D. | 化学反应前后原子的种类不变 |
20.化学元素与人体健康密切相关,下列说法错误的是( )
| A. | 缺钙会引起龋齿 | B. | 缺锌会引起食欲不振,发育不良 | ||
| C. | 缺铁会引起贫血 | D. | 缺碘会引起甲状腺肿大 |
10.根据如表提供的信息,下列判断正确的是( )


| A. | 元素所在的周期数等于其原子的核外电子数 | |
| B. | 钠离子核外有三个电子层 | |
| C. | 第二、三周期元素的原子从左至右最外层电子数逐渐增多 | |
| D. | 在化学变化中镁元素容易失去最外层2个电子形成镁离子,其离子符号是Mg2+ |
1.空气清新剂主要成分基本上都是由乙醚(化学式C4H10O)、香精等组成,乙醚是一种无色、易燃、极易挥发的液体,通过乙醚的喷发带动弥散的香气来暂时掩盖室内异味,但不能真正改善空气的质量.下列有关乙醚的说法正确的是( )
| A. | 乙醚属于有机物 | B. | 乙醚由C、H、O三种原子构成 | ||
| C. | 乙醚中三种元素的质量比为4:10:1 | D. | 吸入乙醚令人神清气爽 |
2.下列有关溶液的说法中,正确的是( )
| A. | 溶液的都是无色透明的液体 | |
| B. | 洗洁精具有溶解作用,能去除餐具上的油污 | |
| C. | 均一、稳定的物质都是溶液 | |
| D. | 味精加入适量水后可以形成溶液 |

 厨房中蕴含许多化学知识,请根据下列要求回答问题.
厨房中蕴含许多化学知识,请根据下列要求回答问题.