题目内容
16.(1)酸和碱反应能生成盐和水,这类反应为中和反应.(2)往小烧杯中倒入5mL氢氧化钠稀溶液,滴入酚酞试液,溶液颜色呈红色,插入温度计,在逐滴加入过量的稀硫酸,可以观察到的颜色变化是由红色变为无色,温度计读数升高.
(3)胃酸(主要成分为盐酸)过多的“泛酸”症状可以用止酸剂(氢氧化镁)治疗,写出反应的化学方程式:Mg(OH)2+2HCl═MgCl2+2H2O.
分析 (1)根据中和反应的概念,进行分析解答.
(2)根据氢氧化钠溶液显碱性,无色酚酞溶液遇酸性溶液不变色,遇碱性溶液变红,稀硫酸能与氢氧化钠溶液发生中和反应生成硫酸钠和水,进行分析解答.
(3)氢氧化镁和胃酸中的盐酸反应生成氯化镁和水,写出反应的化学方程式即可.
解答 解:(1)中和反应是酸与碱作用生成盐和水的反应.
(2)氢氧化钠溶液显碱性,往小烧杯中倒入5mL氢氧化钠稀溶液,滴入酚酞试液,溶液颜色呈红色,插入温度计,在逐滴加入过量的稀硫酸,稀硫酸能与氢氧化钠溶液发生中和反应生成硫酸钠和水,最终溶液下酸性,可以观察到的颜色变化是由红色变为无色.中和反应放热,温度计读数升高.
(3)氢氧化镁和胃酸中的盐酸反应生成氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl═MgCl2+2H2O.
故答案为:(1)盐;水;(2)红;由红色变为无色;升高;(3)Mg(OH)2+2HCl═MgCl2+2H2O.
点评 本题难度不大,掌握中和反应的概念、化学方程式的书写方法等是正确解答本题的关键.

练习册系列答案
相关题目
7.KCl与KNO3在不同温度时的溶解度数据如表,则下列说法正确的是( )
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| KCl | 30g | 33g | 35g | 38g | 41g |
| KNO3 | 21g | 31g | 45g | 65g | 88g |
| A. | KNO3的溶解度大于KCl的溶解度 | |
| B. | 两物质溶解度相等的温度在20~30℃之间 | |
| C. | 在30℃时,5gKN03加入到10g水中可得到33.3%的KN03溶液 | |
| D. | 在50℃时,两物质各10g分别加入20g水中,充分溶解,均没有固体剩余 |
 A~E是初中化学常见的物质,它们的转化关系如图所示(图中“→”代表转化关系,“-”表示相互反应).其中A和B都属于盐,且B可用于补钙,C为氧化物,E是最常用的溶剂.回答下列问题:
A~E是初中化学常见的物质,它们的转化关系如图所示(图中“→”代表转化关系,“-”表示相互反应).其中A和B都属于盐,且B可用于补钙,C为氧化物,E是最常用的溶剂.回答下列问题: 实验室制取二氧化碳后的剩余溶液中含有氯化钙和稀盐酸,现在要将100g此溶液处理后在排放.则此溶液向其中加入质量分数为10.6%的碳酸钠溶液,所加碳酸钠溶液的质量与溶液的pH的关系如图所示:
实验室制取二氧化碳后的剩余溶液中含有氯化钙和稀盐酸,现在要将100g此溶液处理后在排放.则此溶液向其中加入质量分数为10.6%的碳酸钠溶液,所加碳酸钠溶液的质量与溶液的pH的关系如图所示:
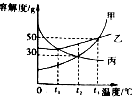 甲、乙、丙三种固体物质的溶解度曲线如图所示,请根据图示回答下列问题.
甲、乙、丙三种固体物质的溶解度曲线如图所示,请根据图示回答下列问题.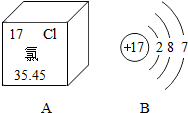 图A是氯元素在元素周期表中的部分信息,图B是氯原子的结构示意图,据此回答问题.
图A是氯元素在元素周期表中的部分信息,图B是氯原子的结构示意图,据此回答问题.