题目内容
10.物质发生化学变化的前后,总质量是否发生改变?是增加、减小还是不变呢?【提出假设】物质发生化学变化前后总质量不变.
【设计实验】甲、乙、丙三位同学设计的实验装置和选用药品分别如图A、B、C所示,他们在反应前后都进行了规范的操作和准确的称量.
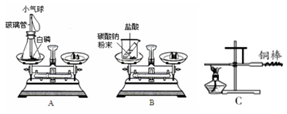
(1)写出A实验发生反应的化学方程式:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.实验装置中气球的作用是平衡装置内外的气压,防止瓶塞飞出.
(2)丙进行了图C所示的实验,用细铁丝系住铜棒使之平衡,然后在铜棒一端用酒精灯加热.左端铜棒加热数分钟,停止加热后冷却,他观察到的现象是加热的一端铜棒变黑,铜棒加热的一端下沉.写出C实验发生反应的化学方程式:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO.
【实验结论】
甲认为:在化学反应中,生成物的总质量与反应物的总质量相等;
乙、丙认为:在化学反应中,生成物的总质量与反应物的总质量不相等.
(3)你认为甲的结论正确,请你认为丙实验结果产生的原因是:铜棒加热时,和空气中的氧气反应生成了氧化铜.
【实验反思】:要使乙的实验能达到反应前后质量不变,可以做出的改变是把烧杯换成塞紧瓶塞的锥形瓶.
分析 (1)白磷燃烧时放热、产生大量白烟,生成五氧化二磷;
(2)加热条件下,铜能和空气中的氧气反应生成氧化铜;
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和;
(3)要使乙的实验能达到反应前后质量不变,可以做出的改变是把烧杯换成塞紧瓶塞的锥形瓶,这样反应物在密闭容器中进行,反应生成的二氧化碳不能逸出装置.
解答 解:(1)A实验中,白磷燃烧生成五氧化二磷,发生反应的化学方程式为:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;
实验装置中气球的作用是平衡装置内外的气压,防止瓶塞飞出.
故填:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;平衡装置内外的气压,防止瓶塞飞出.
(2)在铜棒一端用酒精灯加热,过程中铜和氧气反应生成氧化铜,发生反应的化学方程式为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO.
故填:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO.
(3)甲的结论正确,这是因为化学反应都遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和;
丙实验结果产生的原因是:铜棒加热时,和空气中的氧气反应生成了氧化铜.
故填:甲;铜棒加热时,和空气中的氧气反应生成了氧化铜.
【实验反思】:要使乙的实验能达到反应前后质量不变,可以做出的改变是:把烧杯换成塞紧瓶塞的锥形瓶.
故填:把烧杯换成塞紧瓶塞的锥形瓶.
点评 要使乙的实验能达到反应前后质量不变,也可以把药品换成铁和硫酸铜溶液,或换成氢氧化钠溶液和硫酸铜溶液,要注意理解.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
14.某化学小组要验证混合气体中含有CO2和CO气体.实验室现有下图所示实验装置(可重复使用),按气体从做到右的方向,装置连接顺序正确的是( )
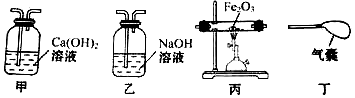

| A. | 甲→乙→甲→丙→甲→丁 | B. | 甲→丙→乙→甲→丁 | ||
| C. | 甲→乙→丙→乙→丁 | D. | 乙→甲→丙→甲→乙 |
15.下列各项实验,能达到目的是( )
| A. | 区别面粉和米粉-------加碘酒 | |
| B. | 鉴别KCl溶液和CaCl2-------分别加入硝酸银 | |
| C. | 除去H2气体中的NH3气体-------先通入水再通入浓硫酸 | |
| D. | 除去粗盐中的氯化镁、硫酸镁杂质--------溶解、过滤、蒸发、结晶 |


 A、B、C、D、E是初中化学常见的物质.C为单质;生活中B 和D都可用来灭火; E广泛用于玻璃、造纸、纺织、洗涤剂的生产.它们之间的一部分关系如图所示,(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系.部分反应物或生成物已略去)
A、B、C、D、E是初中化学常见的物质.C为单质;生活中B 和D都可用来灭火; E广泛用于玻璃、造纸、纺织、洗涤剂的生产.它们之间的一部分关系如图所示,(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系.部分反应物或生成物已略去) A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件己略去).
A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件己略去). ⑤
⑤