题目内容
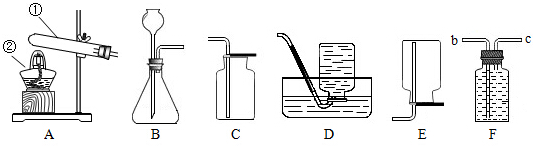
 为了测定空气的成分,同学们按如图装置进行了实验.
为了测定空气的成分,同学们按如图装置进行了实验.(1)将燃烧匙中过量的红磷点燃后,伸入集气瓶中,能观察到的现象是
写出该反应的化学方程式
(2)反应停止后,待集气瓶冷却后打开止水夹,烧杯中的水会
(3)此实验说明
考点:空气组成的测定,书写化学方程式、文字表达式、电离方程式
专题:氧气、氢气的性质与用途
分析:(1)根据红磷的燃烧及实验的目的分析回答;
(2)根据瓶内压强的变化及空气中氧气的含量分析回答;
(3)根据上述实验现象分析实验的结论.
(2)根据瓶内压强的变化及空气中氧气的含量分析回答;
(3)根据上述实验现象分析实验的结论.
解答:解:(1)将燃烧匙中过量的红磷点燃后,伸入集气瓶中,能观察到的现象是:红磷燃烧,产生大量白烟,放出热量;该反应的化学方程式是:4P+5O2
2P2O5,要测定空气中氧气的含量,必需将氧气全部消耗掉.所以过量红磷的作用是:消耗完集气瓶中的氧气.
(2)由于红磷燃烧消耗了氧气,瓶内压强减小,氧气约占空气体积的
,所以,反应停止后,待集气瓶冷却后打开止水夹,烧杯中的水会沿着导管进入集气瓶,达到集气瓶中气体体积的
为止.
(3)由上述实验现象进入集气瓶内的水约占空气体积的
,说明了空气中氧气约占空气体积的
.
故答为:(1)红磷燃烧,产生大量白烟,放出热量;4P+5O2
2P2O5,消耗完集气瓶中的氧气;
(2)沿着导管进入集气瓶,
;(3)空气中氧气含量大约占空气总体积的
.
| ||
(2)由于红磷燃烧消耗了氧气,瓶内压强减小,氧气约占空气体积的
| 1 |
| 5 |
| 1 |
| 5 |
(3)由上述实验现象进入集气瓶内的水约占空气体积的
| 1 |
| 5 |
| 1 |
| 5 |
故答为:(1)红磷燃烧,产生大量白烟,放出热量;4P+5O2
| ||
(2)沿着导管进入集气瓶,
| 1 |
| 5 |
| 1 |
| 5 |
点评:本题考查了空气中氧气含量的测定实验,要注意红磷必须足量才能将装置中的氧气全部消耗才能确保实验的成功.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
我国曾发生过多次将工业用盐亚硝酸钠(NaNO2)误作食盐用于烹调而引起的中毒事件.亚硝酸钠中氮元素的化合价是( )
| A、+2 | B、+3 | C、+4 | D、+5 |