题目内容
17.用31.6克干燥的高锰酸钾固体(假设无杂质)装入大试管中,加热制取氧气.待完全反应后,停止加热,将试管冷却,称量剩余固体的质量.(提示:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,KMnO4相对分子质量为158)计算:
(1)反应生成多少克氧气?(要有计算过程)
(2)剩余固体的质量是g(只填结果)
分析 高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,由参加反应的高锰酸钾的质量,由反应的化学方程式列式计算出生成氧气的质量,进而由质量守恒定律计算出剩余固体的质量即可.
解答 解:(1)设生成氧气的质量为x
2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
316 32
31.6g x
$\frac{316}{32}=\frac{31.6g}{x}$ x=3.2g
(2)由质量守恒定律,剩余固体的质量是31.6g-3.2g=28.4g.
答:(1)反应生成3.2克氧气;(2)剩余固体的质量是28.4g.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
相关题目
12.初三(1)班的小朱人称“小马虎”,下面是从他的笔记中摘录的部分化学用语,你认为正确的是( )
| A. | 碳酸钠:NaCO3 | B. | 水:H2O | ||
| C. | 3个亚铁离子:3Fe3+ | D. | 两个氢原子:H2 |
2.M是一种金属元素,M+与其它几种离子构成的化合物的溶解性见表:
根据以上信息,判断下列反应肯定不能发生的是( )
| OH- | CO32- | Cl- | SO42- | NO3- | |
| M2+ | 难溶 | 难溶 | 易溶 | 易溶 | 易溶 |
| A. | M+HCl | B. | MSO4+Ba(NO3)2 | C. | M(OH)2+NaCl | D. | MO+H2SO4 |
9.根据图中提供的氯元素的信息判断,下列说法错误的是( )
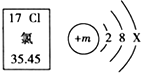

| A. | 图中m的值是17 | B. | 氯元素位于第三周期 | ||
| C. | 氯元素的相对原子质量为35.45 | D. | 在化学变化中,氯原子易失去电子 |
6.下列变化中,属于化学变化的是( )
| A. | 石蜡熔化 | B. | 汽油挥发 | C. | 湿衣晒干 | D. | 木材燃烧 |
 除去CO中的CO2
除去CO中的CO2 制取二氧化碳气体并收集
制取二氧化碳气体并收集 测定水的组成
测定水的组成
