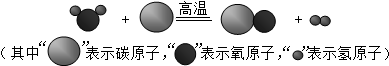
题目内容
16.为测定某大理石样品中碳酸钙的含量,实验小组的同学们称取10g大理石样品于烧杯中,加入50g稀盐酸(盐酸稍过量,且不与大理石中的杂质反应),充分反应后测得烧杯中剩余物质的质量为56.7g.请计算10g大理石样品中碳酸钙的质量.分析 大理石中碳酸钙与盐酸反应放出二氧化碳,利用质量守恒定律,由反应前后各物质质量总和的差值,计算出反应放出二氧化碳的质量;由二氧化碳的质量,根据反应的化学方程式,计算出大理石中所含量碳酸钙的质量.
解答 解:生成二氧化碳的质量=10g+50g-56.7g=3.3g
设样品中碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.3g
$\frac{100}{44}=\frac{x}{3.3g}$
x=7.5g
答:样品中碳酸钙的质量为7.5g.
点评 本题的关键是要知道固体质量的减少量就是生成二氧化碳的质量;根据气体的质量依据化学方程式即可算出碳酸钙的质量.

练习册系列答案
相关题目
7. 某兴趣小组用如图所示装置制取氧气,试管中固体的质量随时间变化的数据见表.制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液100g.
某兴趣小组用如图所示装置制取氧气,试管中固体的质量随时间变化的数据见表.制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液100g.
(1)氧气的相对分子质量=32.
(2)共制得氧气9.6g.
(3)计算所得氯化钾溶液的溶质质量分数.
 某兴趣小组用如图所示装置制取氧气,试管中固体的质量随时间变化的数据见表.制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液100g.
某兴趣小组用如图所示装置制取氧气,试管中固体的质量随时间变化的数据见表.制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液100g.| 加热时间/min | 0 | t1 | t2 | t3 |
| 固体质量/g | 28.0 | 23.2 | 18.4 | 18.4 |
(2)共制得氧气9.6g.
(3)计算所得氯化钾溶液的溶质质量分数.
4.下列过程发生了化学变化的是( )
①葡萄榨汁 ②葡萄酿酒 ③用土烧制瓷器 ④用土堆成土丘 ⑤稻草造纸 ⑥用纸制作风筝 ⑦头发剪断 ⑧头发长长.
①葡萄榨汁 ②葡萄酿酒 ③用土烧制瓷器 ④用土堆成土丘 ⑤稻草造纸 ⑥用纸制作风筝 ⑦头发剪断 ⑧头发长长.
| A. | ②③⑤⑧ | B. | ②③⑤⑥ | C. | ①③⑤⑥ | D. | ①③⑤⑧ |
1.下列有关分子、原子和离子的叙述中,错误的是( )
| A. | 分子是保持物质化学性质的一种粒子 | |
| B. | 分子和原子的根木区別是在化学变化中能否再分 | |
| C. | 分子、原子和离子都可以直接构成物质 | |
| D. | 原子是不能再分的一种粒子 |
1.硬水和软水的区别是( )
| A. | 硬水是化合物,软水是单质 | |
| B. | 硬水是混合物,软水是纯净物 | |
| C. | 硬水中含污染物,软水中无污染物 | |
| D. | 硬水中含较多的可溶性的钙、镁化合物,软水中不含或少含可溶性钙、镁化合物 |
18.用20%的NaOH溶液和蒸馏水,配制10%的NaOH溶液100g,需要20%NaOH浓溶液的质量为( )
| A. | 95g | B. | 10g | C. | 50g | D. | 100g |
19.生活中处处离不开化学,下列化学物质对人类有益的是( )
①使用加碘食盐
②使用铝制炊具
③食用含铁酱油
④食用含磷洗衣粉
⑤食用含钙麦片
⑥使用氟利昂作制冷剂.
①使用加碘食盐
②使用铝制炊具
③食用含铁酱油
④食用含磷洗衣粉
⑤食用含钙麦片
⑥使用氟利昂作制冷剂.
| A. | ①③⑤ | B. | ①②③⑤ | C. | ③④⑥ | D. | ①②③④⑤⑥ |