题目内容
3.工业上常用NaOH溶液处理铝土矿(主要成分为Al2O3),反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O(杂质不参与反应也不溶于水).若用160kgNaOH配制的溶液恰好能处理340kg铝土矿,最终得到1004kgNaAlO2溶液.计算:(1)该铝土矿中Al2O3的质量分数.
(2)加入的NaOH溶液中水的质量.
分析 (1)根据氢氧化钠的质量和方程式计算Al2O3的质量,进一步计算铝土矿中Al2O3的质量分数
(2)根据质量守恒分析加入的NaOH溶液中水的质量.
解答 解:(1)设Al2O3的质量为x
Al2O3+2NaOH=2NaAlO2+H2O
102 80
x 160kg
$\frac{102}{x}$$\frac{80}{160kg}$
x=204kg
铝土矿中Al2O3的质量分数$\frac{204kg}{340kg}$×100%=60%
(2)加入的NaOH溶液中水的质量1004kg-204kg-160kg=640kg
答:(1)铝土矿中Al2O3的质量分数60%
(2)加入的NaOH溶液中水的质量640kg
点评 本题考查了根据化学方程式的计算,完成此题,可以依据已有的知识进行.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
3.下列有关物质的分类正确的是( )
| A. | 稀盐酸属于化合物 | B. | 亚硝酸钠属于盐 | ||
| C. | 冰水共存物属于混合物 | D. | 纯碱属于碱 |
14.下列化学实验基本操作正确的是( )
| A. |  过滤 | B. |  称取氯化钠 | C. |  稀释浓硫酸 | D. |  测溶液的pH |
 垃圾发电是把各种垃圾收集后,进行分类处理.其中:一是对燃烧值较高的进行高温焚烧,在高温焚烧中产生的热能转化为高温蒸气,推动涡轮机转动,使发电机产生电能.二是对不能燃烧的有机物在缺乏空气的条件下进行腐烂发酵、产生一种气体沼气.距测算,1米3的沼气池一天产生沼气量0.2米3.1米3沼气可以供6口之家三餐的烹饪,可以使3吨的卡车运行3千米,点亮60W电灯工作6小时.
垃圾发电是把各种垃圾收集后,进行分类处理.其中:一是对燃烧值较高的进行高温焚烧,在高温焚烧中产生的热能转化为高温蒸气,推动涡轮机转动,使发电机产生电能.二是对不能燃烧的有机物在缺乏空气的条件下进行腐烂发酵、产生一种气体沼气.距测算,1米3的沼气池一天产生沼气量0.2米3.1米3沼气可以供6口之家三餐的烹饪,可以使3吨的卡车运行3千米,点亮60W电灯工作6小时. 已知A、B、C、D、E、F、G、H、M、N均为初中化学中常见的物质,其中A、C、D、M、F为氧化物,组成A与C的元素种类相同;H为可溶性碱;固体X在B中充分燃烧可生成无色气体D;E为常用建筑材料的主要成分.各物质之间的相互关系如图所示(部分反应条件和生成物已省略)
已知A、B、C、D、E、F、G、H、M、N均为初中化学中常见的物质,其中A、C、D、M、F为氧化物,组成A与C的元素种类相同;H为可溶性碱;固体X在B中充分燃烧可生成无色气体D;E为常用建筑材料的主要成分.各物质之间的相互关系如图所示(部分反应条件和生成物已省略)
 水与人类的生活和生产密切相关,请回答下列问题:
水与人类的生活和生产密切相关,请回答下列问题: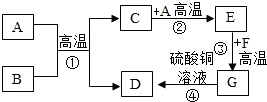 A-H都是初中化学中常见的物质.已知A、B都是黑色固体.D、F为红色固体,它们之间的转化关系如图所示,请回答下列问题:
A-H都是初中化学中常见的物质.已知A、B都是黑色固体.D、F为红色固体,它们之间的转化关系如图所示,请回答下列问题: