题目内容
6.把铁矿石冶炼成铁是一个复杂的过程,但主要反应原理是:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2(1)氧化铁和一氧化碳反应中的还原剂是CO;
(2)200吨含Fe2O3的质量分数为80%的铁矿石中,可提炼出铁的质量多少吨?
分析 (1)根据在氧化还原反应中失氧的是氧化剂,发生还原反应;得氧的是还原剂,发生氧化反应.
(2)利用化学方程式和铁矿石的质量分数、铁矿石的质量,列出比例式,就可计算出理论上可炼出纯铁的质量.
解答 解:(1)在Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2中CO得到氧变成CO2,Fe2O3失去氧变成Fe,故CO是还原剂,发生了氧化反应;Fe2O3是氧化剂,发生了还原反应.故填:CO;
(2)铁矿石中氧化铁的质量为:200t×80%═160t
设理论上可炼出纯铁的质量为x.
Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 112
160t x
$\frac{160}{160t}=\frac{112}{x}$,
x=112t.
答:理论上可炼出纯铁112t.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
17.在炎热的夏天小林从 5℃的冰箱储藏室里拿出一杯底部有少量蔗糖晶体的 a 溶液.在室温下放置一段时间,发现晶体消失了,得到 b 溶液.则下列说法错误的是( )
| A. | 5℃时,a 溶液一定是饱和溶液 | |
| B. | 室温下,b 溶液一定是不饱和溶液 | |
| C. | 蔗糖晶体的溶解度随温度升高而增大 | |
| D. | b 溶液溶质的质量分数一定大于 a 溶液 |
14.往一定量的稀硫酸中加入过量的铁粉,下列图象中正确的是( )
| A. |  | B. |  | C. |  | D. |  |
11.栀子花开,淡淡的清香.香满校园的原因是( )
| A. | 分子是由原子构成的 | B. | 分子的质量和体积都很小 | ||
| C. | 分子在不停的运动 | D. | 分子之间有间隔 |
18.下列常见生活物品中所含的主要材料属于有机合成材料的是( )
| A. | 橡胶轮胎 | B. | 铝制门窗 | C. | 蚕丝围巾 | D. | 玻璃水杯 |
16.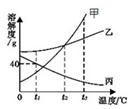 如图所示为甲乙丙三种物质的溶解度曲线,在甲乙丙三中接近饱和的溶液中,通过加入溶质、蒸发溶剂(温度都不变)、升温均可变为饱和溶液的是( )
如图所示为甲乙丙三种物质的溶解度曲线,在甲乙丙三中接近饱和的溶液中,通过加入溶质、蒸发溶剂(温度都不变)、升温均可变为饱和溶液的是( )
 如图所示为甲乙丙三种物质的溶解度曲线,在甲乙丙三中接近饱和的溶液中,通过加入溶质、蒸发溶剂(温度都不变)、升温均可变为饱和溶液的是( )
如图所示为甲乙丙三种物质的溶解度曲线,在甲乙丙三中接近饱和的溶液中,通过加入溶质、蒸发溶剂(温度都不变)、升温均可变为饱和溶液的是( )| A. | 甲溶液 | B. | 乙溶液 | C. | 丙溶液 | D. | 甲乙丙均可 |

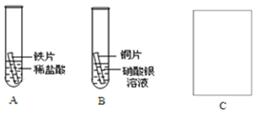 如图所示,小明想通过实验证明铁、铜、银三种金属的活动性顺序.
如图所示,小明想通过实验证明铁、铜、银三种金属的活动性顺序.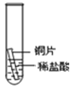 .
.


