题目内容
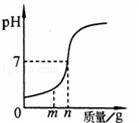
在用稀盐酸和氢氧化钠溶液进行中和反应的实验时,反应过程中溶液的酸碱度变化如图所示.
(1)该反应的化学方程式 .
(2)该实验操作是将 滴加到 另一种溶液中.
(3)当加入溶液的质量为mg时,所得溶液中的溶质为 (写化学式).

【分析】(1)氯化氢与氢氧化钠溶液反应生成氯化钠和水,据此写出反应的化学方程式;
(2)根据坐标变化的趋势结合盐酸的pH小于7,氢氧化钠溶液的pH大于7分析;
(3)当加入溶液的质量为ag时,溶液呈现酸性,溶液中既有生成的氯化钠,又有未反应的盐酸.
【解答】解:(1)稀盐酸与氢氧化钠溶液反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH=NaCl+H2O,
故答案为:HCl+NaOH=NaCl+H2O;
(2)坐标的pH变化是由小于7到大于7的过渡,因此进行的操作是将氢氧化钠溶液滴加到稀盐酸中,
(3)当加入溶液的质量为ag时,溶液呈现酸性,所得溶液中的溶质为氯化氢和氯化钠,
故答案为:HCl、NaCl.
答案:
(1)HCl+NaOH=NaCl+H2O;
(2)氢氧化钠溶液;稀盐酸;
(3)HCl、NaCl.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案《是真的吗》是一档中央电视台财经频道大型互动求证节目.现在跟随化学兴趣小组来一场化学版的《是真的吗》吧.
网上传言:把爆炸盐(如图1)在40﹣60度的热水中完全溶解后,会使污渍像引爆废旧建筑物一样,在瞬间被瓦解.这是真的吗?
实验:用爆炸盐水溶液清洗滴加番茄汁的白布,白布上的番茄汁消失了.
网上传言是真的吗?
资料:市场上出售一种叫做爆炸盐洗衣粉,主要成分是过碳酸钠(2Na2CO3•3H2O2).
【提出问题】爆炸盐溶于水后的产物是什么?
【猜想与假设】猜想1、Ca(OH)2 猜想2、Na2CO3 猜想3、H2O2
小明认为爆炸盐溶于水后的产物不可能是Ca(OH)2,理由是 .
【实验探究】
| 实验编号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 如图2,加适量药品一段时间后,用带火星的木条伸入集气瓶中 | a. | 猜想2和猜想3正确.写出②集气瓶中反应的化学方程式c. |
| ② | 从长颈漏斗再滴加稀盐酸,一段时间后,向集气瓶中倾倒适量澄清石灰水,震荡 | b. |
【实验反思】
在使用爆炸盐溶液时应防止其失效,与下列物质混合不会使其失效的是 .
A、二氧化锰 B、稀硫酸 C、氯化钙 D、硫酸钾.





 4H2O+3CO2,则X的化学式为( )
4H2O+3CO2,则X的化学式为( )