题目内容
11.已知20℃时氯化钠的溶解度为36克.在该温度下,将碳酸钠与氯化钠的混合物17.2克,放入19克水中使其完全溶解,然后加入36.5克质量分数为20%的盐酸溶液,恰好完全反应.求:(1)生成二氧化碳的质量
(2)反应后所得溶液的溶质的质量分数.
分析 (1)根据碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,依据参加反应的盐酸的质量进行计算;
(2)根据化学方程式计算生成氯化钠的质量和样品中氯化钠的质量,然后计算溶液是否饱和,再计算溶液的溶质质量分数.
解答 解:(1)设生成二氧化碳的质量为x,生成氯化钠的质量为y,消耗碳酸钠的质量为z
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 73 117 44
z 36.5g×20%y x
$\frac{106}{z}$=$\frac{73}{36.5%×20g}$=$\frac{117}{y}$=$\frac{44}{x}$
x=10.6g
y=11.7g
z=4.4g
(2)生成溶液中氯化钠的质量为:11.7g+17.2g-10.6g=18.3g
溶液质量为:17.2g+19g+36.5g-4.4g=68.3g
所以水的质量为:68.3g-18.3g=50g,20℃时氯化钠的溶解度为36克,所以反应后所得溶液的溶质的质量分数为:$\frac{18g}{68g}$×100%=26.5%.
故答案为:(1)4.4g;
(2)26.5%.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.

练习册系列答案
相关题目
1.下列物质中属于溶液的是( )
| A. | 少量二氧化碳通入石灰水后得到的混合物 | |
| B. | 液氮 | |
| C. | 牛奶 | |
| D. | 碘酒 |
19.学习化学的目的,不在于要成为化学家,重要的是要善于用化学知识去分析、解决生产、生活中的问题.从化学角度看,下列说法中错误的是( )
| A. | 发现燃气泄漏,点火检查出泄漏处 | |
| B. | 用食醋除去热水瓶中的水垢 | |
| C. | 熟石灰用于改良酸性土壤 | |
| D. | 炒菜时油锅着火,可用锅盖盖灭火焰 |
6.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:
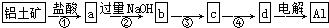
下列说法中错误的是( )
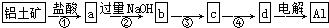
下列说法中错误的是( )
| A. | ①②中除加试剂外,还需要进行过滤操作 | |
| B. | a、b中铝元素的化合价相同 | |
| C. | ③中需要通入过量的氨气 | |
| D. | ④进行的操作是加热,而且d一定是氧化铝 |
4. 家中烧开水的铝壶和盛放开水的暖瓶,使用时间长了易结水垢(如图),因为硬水中含有较多的可溶性的钙、镁的化合物,其中碳酸氢钙[Ca(HCO3)2]受热易分解,生成水和大量的气体,还有一种难溶性的化合物,它是水垢的成分之一.
家中烧开水的铝壶和盛放开水的暖瓶,使用时间长了易结水垢(如图),因为硬水中含有较多的可溶性的钙、镁的化合物,其中碳酸氢钙[Ca(HCO3)2]受热易分解,生成水和大量的气体,还有一种难溶性的化合物,它是水垢的成分之一.
观察与问题:碳酸氢钙受热分解的另外两种生成物质是什么?
假设与预测:①小雨认为生成物中的固体可能是碳酸钙.
②我认为生成物中的气体可能是二氧化碳.
实验与事实:依据猜想我设计如下实验方案:
解释与结论:水垢主要成分之一是碳酸钙.Ca(HCO3)2受热分解的化学方程式为Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3↓+H2O+CO2↑.
 家中烧开水的铝壶和盛放开水的暖瓶,使用时间长了易结水垢(如图),因为硬水中含有较多的可溶性的钙、镁的化合物,其中碳酸氢钙[Ca(HCO3)2]受热易分解,生成水和大量的气体,还有一种难溶性的化合物,它是水垢的成分之一.
家中烧开水的铝壶和盛放开水的暖瓶,使用时间长了易结水垢(如图),因为硬水中含有较多的可溶性的钙、镁的化合物,其中碳酸氢钙[Ca(HCO3)2]受热易分解,生成水和大量的气体,还有一种难溶性的化合物,它是水垢的成分之一.观察与问题:碳酸氢钙受热分解的另外两种生成物质是什么?
假设与预测:①小雨认为生成物中的固体可能是碳酸钙.
②我认为生成物中的气体可能是二氧化碳.
实验与事实:依据猜想我设计如下实验方案:
| 实验步骤 | 猜想正确的实验现象 | 有关化学方程式 | |
| 验证猜想①的方案 | 取少量水垢于试管,滴加稀盐酸,在试管口用燃烧着木条检验 | ||
| 验证猜想②的方案 | 取少量硬水于试管并加热,将生成气体通入澄清的石灰水 |
1.在化学的学习中,同学们知道:聚乙烯塑料只含C、H两种元素,如用焚烧方法处理废弃塑料会造成大气污染.化学兴趣小组对聚乙烯塑料在空气中燃烧生成的碳的氧化物物组成进行探究.
【提出猜想】A.只有CO2 B.只有CO C.既有CO2,也有CO
【查阅资料】微量CO遇到浸有磷钼酸溶液的氯化钯黄色试纸,试纸立即变蓝;而CO2遇该试纸不变色
【设计方案】化学兴趣小组在老师的指导下,设计如图所示实验,通过观察装置B、装置C的实验现象,验证猜想.

【实验探究】请你帮助他们写成实验报告.
【讨论】:根据实验结论,从环保角度考虑,实验中应对尾气进行处理.处理方法是将尾气收集到气囊中(或将尾气点燃).
【提出猜想】A.只有CO2 B.只有CO C.既有CO2,也有CO
【查阅资料】微量CO遇到浸有磷钼酸溶液的氯化钯黄色试纸,试纸立即变蓝;而CO2遇该试纸不变色
【设计方案】化学兴趣小组在老师的指导下,设计如图所示实验,通过观察装置B、装置C的实验现象,验证猜想.

【实验探究】请你帮助他们写成实验报告.
| 实验步骤 | 实验现象 | 实验结论及化学方程式 |
| 点燃酒精灯加热,随即打开弹簧夹,通入干燥的空气. 观察装置B、装置C中的现象 | 装置B中的现象是: 黄色试纸变蓝 装置C中的现象是: 澄清石灰水变浑浊 | 聚乙烯塑料在空气中燃烧,生成碳的氧化物中,既有CO2,也有CO. 装置C中反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O |