题目内容
4.自来水厂常用氯气杀菌消毒,用明矾、氯化铁等净化水.以硫铁矿(主要成分是FeS2)为原料制备氯化铁晶体(FeCl3•6H2O)的流程如图: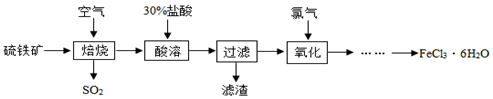
(1)已知“焙烧”阶段就是硫铁矿的燃烧,生成物是Fe2O3和SO2,写出该反应的化学方程式4FeS2+11O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3+8SO2,硫铁矿进行燃烧前要将其粉碎,其目的是加快反应速率,使反应更充分.
(2)大量排放出的SO2能形成酸雨,危害环境,可将含SO2的废气通入氨水中,氨水的pH>7,反应后生成的亚硫酸铵[(NH4)2SO3]在农业上可做氮肥.
(3)①流程中用30%盐酸“酸溶”焙烧后的残渣,写出化学方程式Fe2O3+6HCl=2FeCl3+3H2O,
②在“酸溶”时是否可以用硫酸代替盐酸?不可以(填“可以”或“不可以”),原因是反应后不能生成FeCl3,③若在实验室欲用38%(密度为1.18g/ml)
的盐酸配制30%的盐酸,则需要的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒等.
(4)实际上“焙烧”阶段很难做到将硫铁矿完全反应,因“酸溶”后的混合物中有FeCl2,将其在“氧化”阶段与氯气(Cl2)反应生成FeCl3,写出化学方程式2FeCl2+Cl2=3FeCl3.
分析 (1)根据题中的叙述找出反应物、生成物以及反应条件,然后依据质量守恒定律书写化学方程式;
根据增大反应物的接触面积可以加快反应速率进行分析;
(2)根据大量排放出的SO2能形成酸雨,氨水是一种常见的碱分析,根据足量的二氧化硫,与氨水生成亚硫酸铵,不足量的二氧化硫,与氨水反应生成亚硫酸氢铵进行分析;
(3)根据氧化铁与盐酸的反应写出反应的化学方程式,根据硫酸和氧化铁反应会生成硫酸铁进行分析;
(4)根据题中的反应原理找出反应物、生成物以及反应条件,然后依据质量守恒定律书写化学方程式.
解答 解:(1)硫铁矿和氧气在点燃的条件下生成氧化铁和二氧化硫,化学方程式为:4FeS2+11O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3+8SO2,增大反应物的接触面积可以加快反应速率,所以硫铁矿进行燃烧之前要将其粉碎,增大了反应物的接触面积,其目的是:加快反应速率,使反应更充分;
(2)大量排放出的SO2能形成酸雨,氨水是一种常见的碱,氨水的pH>7,足量的二氧化硫,与氨水生成亚硫酸铵,在农业上可做氮肥;
(3)流程中需用30%的盐酸“酸溶”焙烧后的残渣,盐酸和氧化铁反应生成氯化铁和水,化学方程式为:2Fe2O3+6HCl═2FeCl3+3H2O,酸溶”时可改用硫酸,硫酸和氧化铁反应生成硫酸铁和水,而题中需要制备氯化铁晶体,所以不能改用硫酸,原因是:主产物不再是氯化铁;
(4)通过分析题中的反应原理,酸溶后的混合物中通入氯气制取氯化铁,氯气和氯化亚铁反应生成氯化铁,化学方程式为:2FeCl2+Cl2═2FeCl3.
故答案为:(1)4FeS2+11O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3+8SO2,加快反应速率,使反应更充分;
(2)酸雨,>,氮;
(3)Fe2O3+6HCl=2FeCl3+3H2O,不可以,反应后不能生成FeCl3;玻璃棒,量筒;
(4)2FeCl2+Cl2=3FeCl3.
点评 在解此类题时,首先分析题中的反应原理,然后找出对应的学过的知识点,然后结合题中所给的知识进行分析解答.

| A. | 石墨用于制铅笔芯 | B. | 金属铜丝作导线 | ||
| C. | 氦气用作焊接金属保护气 | D. | 金刚石作钻探机的钻头 |
 某化学兴趣小组探究硫酸和氢氧化钠中和反应时,利用数字化温度传感器 如图所示的实验图,请据图分析,下列结论正确的是( )
某化学兴趣小组探究硫酸和氢氧化钠中和反应时,利用数字化温度传感器 如图所示的实验图,请据图分析,下列结论正确的是( )| A. | 从图线可知中和反应是先放热后吸热 | |
| B. | 在实验过程中a-b的pH增大,b-c的pH减小 | |
| C. | c点时的溶质为H2SO4和Na2SO4 | |
| D. | b点时向溶液中加入酚酞试液,溶液不变色 |
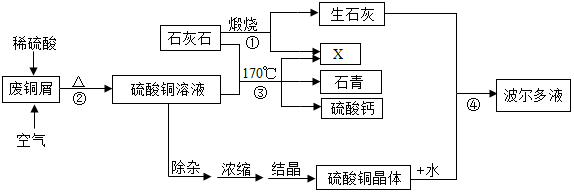
一、产品制备
(1)流程图中X的化学式为CO2;
(2)反应②的总化学方程式为2H2SO4+2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;
(3)硫酸铜晶体(CuSO4•5H2O)的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
Ⅰ是除去晶体表面的杂质;Ⅱ是0℃时,硫酸铜溶解度较小,损失少.
(4)反应④中硫酸铜、生石灰和水制备波尔多液,其化学方程式为:
Ⅰ是CaO+H2O═Ca(OH)2;Ⅱ是Ca(OH)2+CuSO4═CaSO4+Cu(OH)2↓.
二、组成测定
查阅资料得知,石青的化学式可表示为aCuCO3•bCu(OH)2,已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃.为测定其组成,小组同学称取石青样品34.6g,用如图装置进行实验.
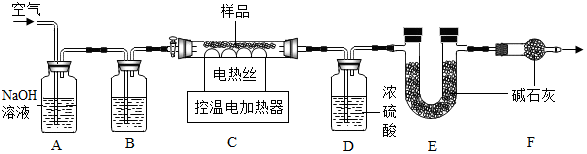
(5)洗气瓶A中氢氧化钠溶液的作用是除去空气中的二氧化碳;B中所装液体为浓硫酸.
(6)现控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止,再缓缓通入一段时间空气后,冷却后装置D增重1.8g,装置E增重8.8g.通过计算可得:a:b=2:1..
(7)若缺少F装置,测得的a:b偏大(选填“偏大”、“偏小”、“不变”).
三、脱水探究
硫酸铜晶体受热会逐步失去结晶水.取纯净CuSO4•5H2O固体2.50g,放在如图实验装置C中进行加热,测定固体质量随温度的变化情况如图所示.
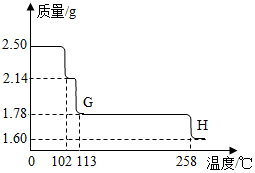
(8)G点固体的化学式是CuSO4•H2O.
(9)G→H看到的现象是白色.
(10)将CuSO4•5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑+5H2O↑.
| A. | 若两个粒子核外电子数相同,则一定属于同种元素 | |
| B. | 同种元素组成的物质,一定是单质 | |
| C. | 金刚石和石墨物理性质存在较大差异是由于碳原子排列方式不同 | |
| D. | 硝酸铵固体溶于水放出热量,天然气燃烧吸收热量 |
| A. | 铁元素 | B. | 铁单质 | C. | 氧化铁 | D. | 铁的化合物 |

