题目内容
7.如下图是实验室常用气体制备装置,据图回答问题.
①用A装置制取氧气的化学方程式是2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.选择D装置收集氧气是因为氧气的密度比空气的密度大.
②实验室制取氨
气:Ca(OH)2(固)+2NH4Cl(固)$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2(固)+2H2O+2NH3↑,要制取并收集干燥的氨气,所选装置正确的连接顺序是A→G→E (填字母代号).
③为探究氨气的性质,按下图装置进行实验.观察到黑色粉末变红,白色无水硫酸铜变蓝,同时反应中还有一种气体单质生成.

【查阅资料】白色无水硫酸铜遇水变蓝色;Cu2O是红色,易与稀硫酸反应:Cu2O+H2SO4═CuSO4+Cu+H2O.
【提出问题】得到的红色物质是什么?
【进行猜想】①是Cu;②是Cu2O;③是 Cu和Cu2O.
若猜想①成立,玻璃管中发生反应的化学方程式为2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2,说明NH3具有还原性.
【设计实验】请你设计一个简单的实验来验证红色物质中是否存在Cu2O:
| 实验步骤 | 实验现象 | 实验结论 |
| 取红色固体于试管中,加入稀硫酸 | 溶液由无色变蓝色 | 证明红色物质中含有Cu2O |
分析 制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.Ca(OH)2(固)+2NH4Cl(固)$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2(固)+2H2O+2NH3↑,因此需要加热,氨气可以用碱石灰干燥,氨气的密度比空气小,应该用向下排空气法收集.玻璃管中发生反应是氨气和氧化铜在加热的条件下生成铜和水和氮气,配平即可,说明氨气具有还原性;设计实验中,取红色固体于试管中,加入稀硫酸,观察到溶液由无色变蓝色,证明红色物质中含有Cu2O.
解答 解:①如果用氯酸钾制氧气就需要加热,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,配平即可;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;故答案为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;氧气的密度比空气的密度大;
②Ca(OH)2(固)+2NH4Cl(固)$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2(固)+2H2O+2NH3↑,因此需要加热,氨气可以用碱石灰干燥,氨气的密度比空气小,应该用向下排空气法收集;故答案为:AGE;
③玻璃管中发生反应是氨气和氧化铜在加热的条件下生成铜和水和氮气,配平即可,说明氨气具有还原性;设计实验中,取红色固体于试管中,加入稀硫酸,观察到溶液由无色变蓝色,证明红色物质中含有Cu2O;故答案为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2;还原;溶液由无色变蓝色;
点评 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、氨气的还原性等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

 阅读快车系列答案
阅读快车系列答案 制造导弹的合金材枓重要元素钕的某些信息如图所示,下列说法正确的是( )
制造导弹的合金材枓重要元素钕的某些信息如图所示,下列说法正确的是( )| A. | 属于非金属元素 | B. | 核内中子数为60 | C. | 原子质量为144.2 | D. | 核内质子数为60 |
| A. | 家用电器着火时,应立即用水浇灭 | |
| B. | 煤气泄漏时,应立即关闭阀门,开窗通风 | |
| C. | 洒出的酒精在桌上燃烧时,应立即用湿抹布扑盖 | |
| D. | 发生火灾时,应立即拨打119火警电话,并采取必要的自救措施 |
| A. | 天然气 | B. | 石油 | C. | 太阳能 | D. | 酒精 |
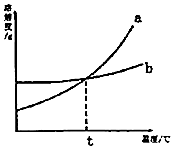 如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )
如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )| A. | a物质的溶解度受温度的影响比b物质小 | |
| B. | t℃时,a、b饱和溶液中含有相同质量的溶质 | |
| C. | t℃时,a的饱和溶液升温,溶质的质量分数变大 | |
| D. | a中含有少量b时,用冷却热饱和溶液的方法提纯a |