题目内容
10.请结合如图所示实验常用装置,回答有关问题.
(1)图中标有字母的仪器的名称:a长颈漏斗.
(2)实验室用高锰酸钾制取氧气,应选用的发生装置A,反应的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)比较用过氧化氢溶液和用高锰酸钾制取O2的方法,两者的共同点是C(填序号).
A.发生装置相同 B.都可用MnO2作催化剂
C.反应的基本类型相同 D.完全反应后剩余固体成分相同
(4)实验室制取二氧化碳的反应方程式为CaCO3+2HCl=CaCO3+H2O+CO2↑.若要获得干燥的二氧化碳,除发生装置外,还应选用D装置,并在该装置中盛放浓硫酸(填写试剂名称).如果用E装置收集该气体,则气体从b端进入(填“b”或“c”).
(5)实验室常用装置C代替装置B制取气体,该装置的优点是可以随时控制反应的发生和停止,下列反应适用于该装置的是①③(填序号).
①大理石和稀盐酸 ②碳酸钠固体和稀硫酸
③锌粒与稀硫酸 ④过氧化氢溶液与二氧化锰.
分析 (1)根据仪器的用途判断;
(2)根据发生装置和收集装置的选择条件进行判断,根据高锰酸钾分解的反应原理书写化学方程式;
(3)可根据两种制取氧气的反应原理进行对比;
(4)据实验室制二氧化碳的原理正确写出化学方程式;浓硫酸具有吸水性,能作干燥剂,能干燥酸性气体和中性气体;
(5)根据C装置与B装置的使用原理和方法回答.装置C适合块状固体与液体反应.
解答 解:
(1)根据图示,a长颈漏斗;
(2)实验室用高锰酸钾制取氧气,发生装置属于“固体加热型”制气体;氧气不溶于水,可以采用排水法收集;氧气密度比空气大,可以采用向上排空气法收集,高锰酸钾加热生成锰酸钾、二氧化锰和氧气,方程式是 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)对比两种方法可知因为条件不同所以反应装置不同,二氧化锰第一个是催化剂,第二个是生成物,反应类型都是分解反应,生成物不相同;故填:C;
(4)实验室用大理石和稀盐酸制取二氧化碳,方程式为CaCO3+2HCl=CaCO3+H2O+CO2↑,要干燥二氧化碳需用浓硫酸,二氧化碳密度比空气大,用E装置收集二氧化碳时只能从b端进入.
故答案是:CaCO3+2HCl=CaCO3+H2O+CO2↑;浓硫酸;b;
(5)将B换成C,则当需要气体时,将多孔隔板向下移入液体药品中,当不需要气体时,将多孔隔板向上移出液体药品,从而能够随时控制反应的发生和停止.选用C装置反应物必须是块状固体和液体,而碳酸钠固体是粉末,二氧化锰是粉末状;
答案:
(1)长颈漏斗;
(2)A;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)C;
(4)CaCO3+2HCl=CaCO3+H2O+CO2↑;浓硫酸;b;
(5)可以随时控制反应的发生和停止;①③.
点评 气体的制取是初中重要的化学实验之一,既是重难点,又是考查热点,理解反应原理,掌握装置的选择依据、气体的收集方法,了解实验步骤和注意事项是解决该类问题的关键.

| A. |  阜阳剪纸 | B. |  徽州石刻 | C. |  舒席编织 | D. |  界首彩陶 |
| A. | 碳在氧气中燃烧放出白烟 | |
| B. | 硫在氧气中燃烧产生淡蓝色的火焰 | |
| C. | 铁丝在氧气中燃烧生成黑色的四氧化三铁 | |
| D. | 一氧化碳在空气中燃烧产生蓝色火焰 |
| A. | 紫色石蕊试液 | B. | 锌粒 | C. | 碳酸钠溶液 | D. | 稀盐酸 |
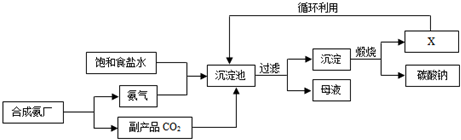
| A. | 沉淀池中的反应物只有两种 | |
| B. | 物质X是氨气,它可以循环使用 | |
| C. | 沉淀为碳酸钙 | |
| D. | 通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀 |
 甲、乙两种物质的溶解度曲线如图所示,下列说法错误的是( )
甲、乙两种物质的溶解度曲线如图所示,下列说法错误的是( )| A. | t1℃时,甲和乙的溶解度相等 | |
| B. | t1℃时,20g乙加到100g水中形成饱和溶液 | |
| C. | t2℃时,甲乙各100g饱和溶液降温到t1℃析出的晶体甲比乙多30g | |
| D. | 若家中含有少量乙,提纯甲可用冷却热饱和溶液的方法 |
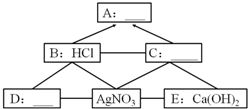 A、B、C、D、E分别表示常见的单质、氧化物、酸、碱、盐中的各一种物质.它们之间的转化关系如图(“-”表示物质之间能反应,“→”表示物质间能转化).
A、B、C、D、E分别表示常见的单质、氧化物、酸、碱、盐中的各一种物质.它们之间的转化关系如图(“-”表示物质之间能反应,“→”表示物质间能转化).