题目内容
20. 先称取一定质量的氯酸钾和二氧化锰混合物,放入大试管中加热至质量不再变化为止.根据质量守恒定律,固体物质减轻的质量即为产生氧气的质量,从而求出氯酸钾的质量.(学习小组同学事先查阅资料获知,二氧化锰的质量在反应前后不变且在水中难溶)
先称取一定质量的氯酸钾和二氧化锰混合物,放入大试管中加热至质量不再变化为止.根据质量守恒定律,固体物质减轻的质量即为产生氧气的质量,从而求出氯酸钾的质量.(学习小组同学事先查阅资料获知,二氧化锰的质量在反应前后不变且在水中难溶)实验测得固体混合物质量随加热时间变化的相关数据如图所示.求:
(1)反应中产生氧气的质量为4.8 g;
(2)原混合物中氯酸钾的质量分数.
分析 (1)根据质量守恒定律,固体物质减轻的质量即为产生氧气的质量;
(2)利用氯酸钾分解的化学方程式,计算出混合物中氯酸钾的质量,再计算出原混合物中氯酸钾的质量分数.
解答 解:(1)根据质量守恒定律,反应中产生氧气的质量为:16.0g-11.2g=4.8g;
(2)设原混合物中氯酸钾的质量为x,
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
245 96
x 4.8g
∴$\frac{245}{96}=\frac{x}{4.8g}$ 解之得:x=12.25g;
原混合物中氯酸钾的质量分数是:$\frac{12.25g}{16g}×100%$≈76.6%
答:(1)反应中产生氧气的质量为4.8g;(2)原混合物中氯酸钾的质量为分数:76.6%.
点评 本题主要考查学生利用化学方程式和质量守恒定律进行计算的能力.根据质量守恒定律,可以求出生成气体的质量,为答题打开突破口.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
8.通过观察实验现象获得证据,从而归纳出相关结论是科学上常用的研究方法,下列实验现象和对应的结论正确的是( )
| A. | 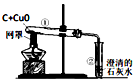 试管①红色粉末变成黑色,试管②的澄清石灰水变浑浊,说明碳具有还原性 | |
| B. |  铁丝表面覆盖红色物质,溶液由蓝色逐渐变成无色,说明铁的金属活动性强于铜 | |
| C. |  烧杯中的红色溶液逐渐变浅最后变成无色,说明盐酸与氢氧化钠能发生反应 | |
| D. | 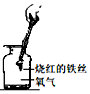 铁丝在氧气中剧烈燃烧、火星四射,生成的黑色物质是氧化铁 |
15.为减少污染、提高煤的利用率,可将其转化为可燃性气体,其微观示意图如图所示:下列说法正确的是( )

| A. | 图中表示化合物的是“ ” ” | |
| B. | 反应物与生成物均由分子构成 | |
| C. | 该反应中生成物两种分子的个数比为2:1 | |
| D. | 反应前后原子的种类和数目保持不变 |
12. 小陈利用如图所示装置进行气体性质的探究实验.A处通入无色气体(可能是H2或CO);B处玻璃管中盛放黑色粉末CuO,C处试管中盛放澄清石灰水溶液.
小陈利用如图所示装置进行气体性质的探究实验.A处通入无色气体(可能是H2或CO);B处玻璃管中盛放黑色粉末CuO,C处试管中盛放澄清石灰水溶液.
(1)根据要求完成下表填写:
(2)实验Ⅰ通过B处的现象已能确定有铜这种产物,还需要在B与C之间加装一个装有无水硫酸铜(填药品名称)的干燥管,就能确定另一产物是水.
(3)实验Ⅱ、Ⅲ的D处导管尖嘴口需用酒精灯点燃的目的是把一氧化碳转化成二氧化碳,防止污染环境.
 小陈利用如图所示装置进行气体性质的探究实验.A处通入无色气体(可能是H2或CO);B处玻璃管中盛放黑色粉末CuO,C处试管中盛放澄清石灰水溶液.
小陈利用如图所示装置进行气体性质的探究实验.A处通入无色气体(可能是H2或CO);B处玻璃管中盛放黑色粉末CuO,C处试管中盛放澄清石灰水溶液.(1)根据要求完成下表填写:
| 序号 | 探究实验 | 简答 |
| Ⅰ | 若为H2与CuO的反应 | B处玻璃管观察到现象:出现水珠. |
| Ⅱ | 若为CO与CuO的反应 | B处反应的化学方程式:CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2, 发生氧化反应的物质是:CO. |
| Ⅲ | 若为CO2与C 的反应 (B处换成酒精喷灯加热) | B处的黑色粉末逐渐减少,最后消失, D处观察到有蓝色的火焰. |
(3)实验Ⅱ、Ⅲ的D处导管尖嘴口需用酒精灯点燃的目的是把一氧化碳转化成二氧化碳,防止污染环境.

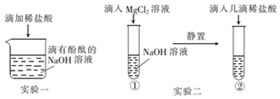 实验小组在探究“酸与碱能否发生反应”时,进行了如图所示实验.请根据实验回答:
实验小组在探究“酸与碱能否发生反应”时,进行了如图所示实验.请根据实验回答: