题目内容
15.甲、乙、丙、丁4种常见物质,由氢、碳、氧、钠、钙5种元素中的2-3种组成.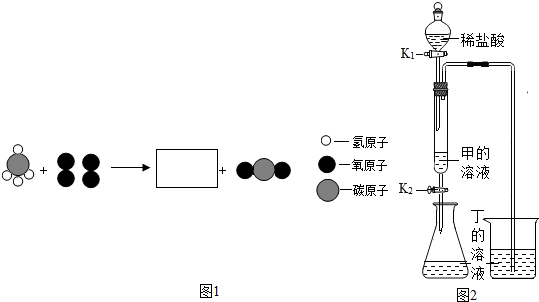
(1)甲俗称纯碱,其化学式为Na2CO3.
(2)乙是一种氧化物,吸水后可变成丁.乙常用作食品干燥剂,检验其还有无干燥效果的化学原理是CaO+H2O=Ca(OH)2 (用化学方程式表示).
(3)丙与氧气在点燃条件下反应,其微观示意如图1,方框中相应微粒的化学式为H2O.该反应中丙与氧气的质量比为1:2.
(4)如图2所示(夹持仪器略去,K1、K2均关闭),打开K1,待液体全部流下,立即关闭,观察到产生大量气泡,且烧杯中丁的溶液变浑浊.充分反应后,打开K1和K2使液体全部流人锥形瓶,瓶中无明显现象.
①用化学方程式表示烧杯中溶液变浑浊的原因CO2+Ca(OH)2═CaCO3↓+H2O
②取反应后锥形瓶中的溶液少许于试管中,加入少量氧化铜粉末,发现固体溶解,溶液变蓝.此时锥形瓶中溶液的溶质有3种.
分析 (1)碳酸钠俗称纯碱,写出化学式;
(2)根据氧化钙与水反应生成了氢氧化钙能放出大量的热分析回答;
(3)根据质量守恒定律反应前后原子的种类、数目不变分析;
(4)①根据二氧化碳能与氢氧化钙反应生成了碳酸钙沉淀和和水分析回答;
②根据盐酸、碳酸钠、氢氧化钙的性质分析.
解答 解:(1)甲俗称纯碱,则甲为碳酸钠,化学式为Na2CO3.
(2)由于氧化钙与水反应生成了氢氧化钙能放出大量的热,氧化钙是由钙、氧两种元素组成的,属于氧化物,由此可知,乙的名称是氧化钙,检验其还有无干燥效果的化学原理是:CaO+H2O=Ca(OH)2.
(3)由物质的微观构成可知,丙为甲烷,燃烧生成了二氧化碳和水,由质量守恒定律反应前后原子的种类、数目不变可知,在方框中补应补充两个水分子,见下图: ,方框中相应微粒的化学式为:H2O,该反应中丙与氧气的质量比为(12+1×4):16×2=1:2..
,方框中相应微粒的化学式为:H2O,该反应中丙与氧气的质量比为(12+1×4):16×2=1:2..
(4)①由于盐酸与碳酸钠反应生成的二氧化碳能使氢氧化钙溶液变浑浊,氢氧化钙是由上述中的元素组成的,所以,丁物质是氢氧化钙,反应的方程式是:CO2+Ca(OH)2═CaCO3↓+H2O.
②由题意可知,取反应后锥形瓶中的溶液少许于试管中,加入少量氧化铜粉末,发现固体溶解,溶液变蓝,说明溶液中有剩余的盐酸,则碳酸钠、氢氧化钙完全反应,该溶液中含有的溶质除HCl外,还有盐酸与碳酸钠、氢氧化钙生成的NaCl、CaCl2.
故答为:
(1)Na2CO3;
(2)CaO+H2O=Ca(OH)2;
(3)H2O; 1:2;
(4)①CO2+Ca(OH)2═CaCO3↓+H2O;②3.
点评 本题的推断由组成物质的元素做为限定条件,因此,熟悉常见物质的组成、性质及变化规律对该题中所涉及物质的推断就至关重要了.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.某学生用量筒取液体时,量筒平稳地放置在实验台上,使视线与凹液面的最低点保持水平,读数为18mL;倒出部分液体后,俯视凹液面的最低处,读数为12mL,则该学生实际倒出的液体体积为( )
| A. | 肯定大于6 mL | B. | 肯定小于6 mL | ||
| C. | 肯定等于6 mL | D. | 可能大于也可能小于6 mL |
6.下列应用和相应原理(用化学方程式表示)及基本反应类型都正确的是( )
| A. | 用氢氧化钠溶液吸收二氧化碳:CO2+2NaOH═Na2CO3+H2O 复分解反应 | |
| B. | 溶洞的形成:CaCO3+H2O+CO2═Ca(HCO2)2 化合反应 | |
| C. | 实验室制取氢气:Fe+2HCl═FeCl2+H2 置换反应 | |
| D. | 用氢氧化镁治疗胃酸过多:Mg(OH)2+H2SO4═MgSO4+2H2O 中和反应 |
4.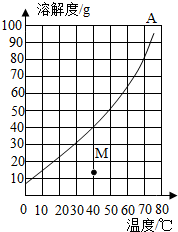 如图是A物质的溶解度曲线图,如表是B物质在不同温度时的溶解度.
如图是A物质的溶解度曲线图,如表是B物质在不同温度时的溶解度.
(1)请根据如表数据在图上绘制出B物质的溶解度曲线.
(2)40℃时,A、B两种物质的饱和溶液中溶质的质量分数相等.
(3)若要从A的溶液中提取A物质,小明同学认为要用蒸发溶剂水的方法;小娟同学认为要用冷却热饱和溶液结晶的方法.你认为小娟同学的方法合理.
(4)40℃时,将50gA物质加入100g水中,充分溶解后,形成溶液的质量为140g.
 如图是A物质的溶解度曲线图,如表是B物质在不同温度时的溶解度.
如图是A物质的溶解度曲线图,如表是B物质在不同温度时的溶解度. | 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| B物质溶解度/g | 32 | 35 | 40 | 45 | 55 |
(2)40℃时,A、B两种物质的饱和溶液中溶质的质量分数相等.
(3)若要从A的溶液中提取A物质,小明同学认为要用蒸发溶剂水的方法;小娟同学认为要用冷却热饱和溶液结晶的方法.你认为小娟同学的方法合理.
(4)40℃时,将50gA物质加入100g水中,充分溶解后,形成溶液的质量为140g.
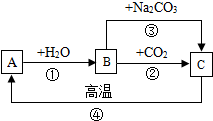 A、B、C是三种常见的含钙化合物.它们之间有如图所示的转化关系(部分产物略去).
A、B、C是三种常见的含钙化合物.它们之间有如图所示的转化关系(部分产物略去).