题目内容
2.对化石燃料的综合利用是目前研究的热点问题之一.(1)三大化石燃料指的是煤、石油和天然气.煤在燃料燃烧时产生二氧化硫和二氧化氮,若不加处理直接排放,会导致酸雨的形成.
(2)煤的气化是一种重要的综合利用技术,其过程如图I所示.
合成气中的物质A和B在一定条件下反应可生成物质C和D,其微观过程如图II所示
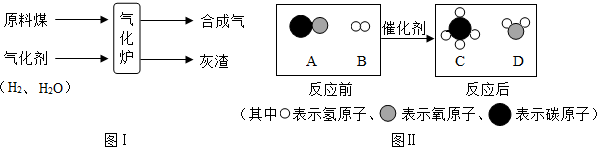
①气化炉中主要发生了化学(填“物理”或“化学”)变化.
②A、B、C、D四种物质中,属于氧化物的是AD(填字母序号).
③写出物质C在氧气中燃烧的化学方程式:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
④在反应A+B C+D中,发生变化的B和C的质量比为3:8.
(3)实验室用含杂质10%的石灰石100g加入足量的稀盐酸反应(假设杂质不与盐酸反应),求:产生的二氧化碳的质量是多少?(请写出计算过程)
分析 (1)根据常见的化石燃料的分类进行分析;根据造成酸雨的主要原因进行分析;
(2)根据氧化物是由两种元素组成其中一种是氧元素的化合物;根据反应物和生成物写出反应的化学方程式,求出各物质之间的质量比解答;
(3)根据碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,根据提供的数据可以计算生成二氧化碳的质量.
解答 解:(1)煤、石油和天然气是三大化石燃料,煤在燃料燃烧时产生二氧化硫和二氧化氮,若不加处理直接排放,会导致酸雨的形成.
(2)①气化炉中反应后生成了新的物质,属于化学变化;
②A是一氧化碳,B是氢气,C是甲烷,D是水,属于氧化物的是一氧化碳和水;
③甲烷燃烧能生成水和二氧化碳,故填:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;
④根据反应的化学方程式,
CO+3H2=CH4+H2O
6 16
故B和C的质量比是6:16=3:8;
(3)解:设生成二氧化碳的质量为X.
石灰石中含碳酸钙的质量=100g×(1-10%)=90g
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
90g X
100:44=90g:X
X=39.6g.
答:生成CO2的质量39.6克.
故答案为:(1)石油;二氧化硫和二氧化氮;(2)①化学;②AD;③CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;④3:8;(3)39.6克.
点评 本题主要考查了能源问题、氧化物的概念以及化学方程式的书写,难度不大.

练习册系列答案
相关题目
12.属于物理变化的是( )
| A. | 燃放烟花爆竹 | B. | 牛奶变酸 | ||
| C. | 光合作用 | D. | 分离液态空气制氧气 |
17.下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
| 选项 | A | B | C | D |
| 实 验 装 置 |  硫在氧气中燃烧 |  测定空气中氧气含量 |  铁丝在氧气中燃烧 |  排水法收集氢气 |
| 解释 | 集气瓶中的水:吸收放出的热量 | 量筒中的水:通过水体积的变化得出O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水:水先将集气瓶内的空气排净,后便于观察H2何时收集满 |
| A. | A | B. | B | C. | C | D. | D |
7.氢氟酸(HF)可用于在玻璃上雕刻各种精美的图案,原理是它跟玻璃发生了化学反应:SiO2+4HF=X↑+2H2O,关于物质X的组成,下列说法正确的是( )
| A. | X的化学式是SiF4 | B. | X是一种氧化物 | C. | 可能含有氧元素 | D. | 可能含有氢元素 |
11.下列变化只涉及物理变化的是( )
| A. | 光合作用 | B. | 自然界中的碳循环 | ||
| C. | 葡萄酿酒 | D. | 干冰用于人工降雨 |
12. 10℃时,向两只试管中加入等质量的甲、乙两种固体物质,分别加入10g水,使其充分溶解,观察到如图1所示的现象.图2是甲、乙两种物质的溶解度曲线.下列说法错误的是( )
10℃时,向两只试管中加入等质量的甲、乙两种固体物质,分别加入10g水,使其充分溶解,观察到如图1所示的现象.图2是甲、乙两种物质的溶解度曲线.下列说法错误的是( )
 10℃时,向两只试管中加入等质量的甲、乙两种固体物质,分别加入10g水,使其充分溶解,观察到如图1所示的现象.图2是甲、乙两种物质的溶解度曲线.下列说法错误的是( )
10℃时,向两只试管中加入等质量的甲、乙两种固体物质,分别加入10g水,使其充分溶解,观察到如图1所示的现象.图2是甲、乙两种物质的溶解度曲线.下列说法错误的是( )| A. | 10℃时,甲一定是饱和溶液 | |
| B. | 10℃时,乙一定是不饱和溶液 | |
| C. | 给两支试管加热至30℃,甲、乙溶液的溶质质量分数相等 | |
| D. | 30℃时,将两支试管溶液制成饱和溶液,则它们的质量:甲>乙 |

