题目内容
为测定某纯碱样品(含少量氯化钠杂质)中碳酸钠的含量,取12g样品放入烧杯中,加入100g稀盐酸,恰好完全反应.经测定,所得溶液常温下为不饱和溶液,其质量为107.6g(产生的气体全部逸出).试计算:
(1)反应生成二氧化碳的质量为 g.
(2)12g样品中碳酸钠的质量为 g.
(3)稀盐酸中溶质的质量分数(写出计算过程).
(4)反应后溶液中溶质的质量分数为 .
(1)反应生成二氧化碳的质量为
(2)12g样品中碳酸钠的质量为
(3)稀盐酸中溶质的质量分数(写出计算过程).
(4)反应后溶液中溶质的质量分数为
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)根据质量守恒定律结合物质的质量反应前后的变化可得出生成的二氧化碳的质量;
(2)根据化学方程式结合二氧化碳的质量可以计算出碳酸钠的质量;
(3)根据化学方程式结合二氧化碳的质量可以计算出稀盐酸中溶质的质量,进而计算出稀盐酸中溶液的质量分数
(4)反应后溶液中溶质是氯化钠.氯化钠质量等于纯碱样品含有的氯化钠和反应生成的氯化钠,再根据溶质的质量分数计算即可.
(2)根据化学方程式结合二氧化碳的质量可以计算出碳酸钠的质量;
(3)根据化学方程式结合二氧化碳的质量可以计算出稀盐酸中溶质的质量,进而计算出稀盐酸中溶液的质量分数
(4)反应后溶液中溶质是氯化钠.氯化钠质量等于纯碱样品含有的氯化钠和反应生成的氯化钠,再根据溶质的质量分数计算即可.
解答:解:(1)根据质量守恒定律,可得出生成的二氧化碳的质量为:12g+100g-107.6g=4.4g;
(2)设12g样品中碳酸钠的质量为x,生成的氯化钠质量为y,稀盐酸中溶质的质量为z
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x z y 4.4g
=
=
=
解得:x=10.6g,y=11.7g,z=7.3g
(3)稀盐酸中溶质的质量分数是:
×100%=7.3%
(4)所得溶液溶质的质量分数为:
×100%=12.2%
故答为:(1)4.4;(2)10.6;(3)7.3%;(4)所得溶液溶质的质量分数为12.2%.
(2)设12g样品中碳酸钠的质量为x,生成的氯化钠质量为y,稀盐酸中溶质的质量为z
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x z y 4.4g
| 106 |
| x |
| 73 |
| z |
| 117 |
| y |
| 44 |
| 4.4g |
解得:x=10.6g,y=11.7g,z=7.3g
(3)稀盐酸中溶质的质量分数是:
| 7.3g |
| 100g |
(4)所得溶液溶质的质量分数为:
| 12g-10.6g+11.7g |
| 107.6g |
故答为:(1)4.4;(2)10.6;(3)7.3%;(4)所得溶液溶质的质量分数为12.2%.
点评:此题是对化学方程式以及溶液相关问题的考查,利用质量守恒定律,计算出反应放出二氧化碳的质量是解决问题的基础.

练习册系列答案
相关题目
下列关于水的说法正确的是( )
| A、氢气和氧气组成 |
| B、两个氢原子和一个氧原子构成 |
| C、氢元素和氧元素组成 |
| D、氢分子和氧分子构成 |
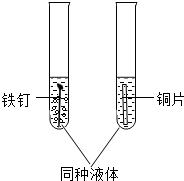 为了验证铁、铜两种金属的活动性差异,如图所示取2支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是( )
为了验证铁、铜两种金属的活动性差异,如图所示取2支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是( )| A、蒸馏水 | B、稀盐酸 |
| C、酒精水溶液 | D、蔗糖溶液 |



