题目内容
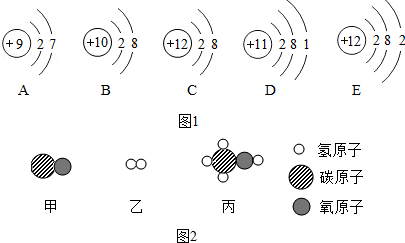
13. 如图A、B、C、D、甲、乙、丙、丁都是我们已学过的物质.(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,部分反应物、生成物及反应条件已略去.)甲、乙、丙、丁均是氧化物,且乙是黑色固体.A、B是单质,D是补钙剂,且D和C的组成元素中有两种是相同的.
如图A、B、C、D、甲、乙、丙、丁都是我们已学过的物质.(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,部分反应物、生成物及反应条件已略去.)甲、乙、丙、丁均是氧化物,且乙是黑色固体.A、B是单质,D是补钙剂,且D和C的组成元素中有两种是相同的.(1)C的化学式是Ca(OH)2,D的化学式是CaCO3.
(2)若A为紫红色固体,写出乙→丁的化学反应方程式H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O反应的基本反应类型为置换反应.
(3)若A的年产量位于世界第一.写出乙+甲 的化学反应方程式Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2.
分析 根据“D是补钙剂”,推测D为碳酸钙,根据“D和C的组成元素中有两种是相同的”,则推测C可能为氢氧化钙,根据“甲、乙、丙、丁均是氧化物,且乙是黑色固体,A、B是单质”,结合图框,根据丙与C反应生成D和丁,则推测丙为二氧化碳,丁为水;根据甲、乙反应生成丙和A;乙、B反应生成A和丁,则推测甲、乙分别为一氧化碳和氧化铜,A、B分别为铜、氢气,代入检验.
解答 根据“D是补钙剂”,推测D为碳酸钙,根据“D和C的组成元素中有两种是相同的”,则推测C可能为氢氧化钙,根据“甲、乙、丙、丁均是氧化物,且乙是黑色固体,A、B是单质”,结合图框,根据丙与C反应生成D和丁,则推测丙为二氧化碳,丁为水;根据甲、乙反应生成丙和A;乙、B反应生成A和丁,则推测甲、乙分别为一氧化碳和氧化铜,A、B分别为铜、氢气,代入检验,符合题意.
(1)根据分析,C可能为氢氧化钙,D为碳酸钙,故C的化学式是Ca(OH)2;D的化学式是CaCO3;
(2)若A为紫红色固体,反应乙→丁,即氢气与氧化铜反应,故其化学反应方程式H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;反应的基本反应类型为置换反应;
(3)若A的年产量位于世界第一,则为铁,反应乙+甲,即四氧化三铁与一氧化碳反应,故其化学反应方程式Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2.
故答案为:
(1)Ca(OH)2;CaCO3;(2)H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;置换反应;(3)Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2;
点评 解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口,顺藤摸瓜得出结论,最后把结论代入原题中验证,能自圆其说即可.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案| A. | 食醋 | B. | 矿泉水 | C. | 苹果汁 | D. | 液氧 |
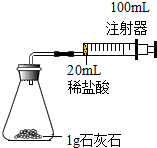 某化学实验小组对“影响石灰石与盐酸反应速率的因素-盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与:
某化学实验小组对“影响石灰石与盐酸反应速率的因素-盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与:【进行实验】常温下,选用20ml不同溶质质量分数的盐酸(4%和6%)分别与1g颗粒状或块状的石灰石进行实验(固定夹持仪器略去).
(1)石灰石与盐酸反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)按如图装置进行实验,在装药品前应检查该装置的气密性,具体的做法是将导管一端浸入水中,用手紧握容器外壁,有气泡产生,开始实验时,应将20ml稀盐酸快速(选填“快速”或“缓慢”)推入锥形瓶中,以保证盐酸能全部推入锥形瓶中.
【处理数据】
(3)实验小组进行实验后,获得的相关实验数据如下表所示:
| 实验编号 | 盐酸溶质质量分数(均取20ml) | 石灰石固体性质(均取1g) | 二氧化碳体积(ml)(均收集前30s的气体) |
| a | 4% | 颗粒 | 64.0 |
| b | 4% | 块状 | 40.4 |
| c | 6% | 颗粒 | 98.2 |
| d | 6% | 块状 | 65.3 |
②从上述实验中得出石灰石的颗粒大小对反应速率影响的结论是颗粒越小,反应的速率越大.
【拓展延伸】
(4)下表是实验时记录生成的二氧化碳气体体积和对应的时间的一组实验数据(每间隔4s读数一次):
| 时间/s | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | 36 | 40 |
| 气体体积/ml | 16.0 | 22.2 | 29.4 | 39.3 | 50.4 | 57.6 | 62.0 | 64.7 | 66.0 | 66.0 |
(5)你认为影响石灰石与盐酸反应速率的因素还有石灰石的纯度,请设计实验方案验证你的猜想.
 已知ABCD分别为H2SO4、NaOH、CuCl2和CuO中的一种.它们之间的关系如图所示(“--”表示能反应,“…”表示不能反应):
已知ABCD分别为H2SO4、NaOH、CuCl2和CuO中的一种.它们之间的关系如图所示(“--”表示能反应,“…”表示不能反应):
 如图是氯化钾和硝酸钾两种固体溶解度曲线图.
如图是氯化钾和硝酸钾两种固体溶解度曲线图. 某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO4.
某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO4.