题目内容
下列含氮物质中,氮元素的化合价最低的是
A. NO B. NO2 C. NH3 D. N2
C 【解析】A、氧元素显-2价,设NO中氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(-2)=0,则x=+2价;B、氧元素显-2价,设NO2中氮元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:y+(-2)=0,则y=+2价;C、氢元素显+1价,设NH3中氮元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:z+(+1)×3=0,则z=-3价; D、单... 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取80g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
样品编号 | ① | ② | ③ | ④ |
稀盐酸的质量 | 50g | 100g | m(150<m<250) | 250g |
剩余固体的质量 | 15g | 10g | 4g | 4g |
然后,为了探究石灰石与稀盐酸反应后所得溶液中的溶质成分,将编号③所得溶液过滤,取滤液质量的1/8于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示:

分析题中有关信息和图表(横坐标表示碳酸钠溶液、纵坐标为生成沉淀质量),回答下列问题:
(1)该石灰石样品的纯度为______.所用盐酸的溶质质量分数为__________。
(2)编号③所用稀盐酸的质量m为______g.
(3)A点处对应的溶液中溶质的质量是________?(写出计算过程)
80% 7.3% 200克 29.25克 【解析】【解析】 (1)该石灰石样品的纯度为×100%=80%; 50g盐酸消耗的碳酸钙质量为20g-15g=5g,设50g盐酸的溶质质量为x CaCO3+2HCl=CaCl2+H2O+CO2↑ 100 73 5g x x=3.65g 所用盐酸的溶质质量分数为×100%=7.3%; (2)设编号③...某兴趣小组在准备化学实验基本技能考试时,对以下问题进行了探究。
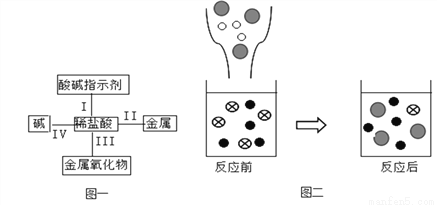
I.探究酸和碱能否发生化学反应
(1)方案l:甲同学向盛有少量NaOH溶液的试管中滴几滴无色酚酞试液,振荡,继续加入稀硫酸,观察到溶液由________色变成无色。甲同学得出结论:酸和碱能发生反应。
方案2:乙同学取少量NaOH溶液,测得溶液pH为10,向该溶液中加入一定量稀硫酸后,测得溶液pH为9,乙同学发现溶液pH减小了,得出结论:酸和碱能发生反应。
(2)交流讨论:大家同意甲同学的结论,对乙同学的实验过程提出质疑,溶液pH减小的原因还可能是稀硫酸中的水稀释了NaOH溶液;大家认为,乙同学向NaOH溶液中加入稀硫酸后,测得溶液的pH必须________7(填“大于”、“小于”或“等于”),才能证明酸和碱能发生反应。
II.探究酸和碱反应后溶液中溶质的成分
丙同学对探究I中甲同学实验后的无色溶液展开探究。
【提出问题】试管中无色溶液的溶质除了酚酞还有什么?
【提出猜想】猜想(l):Na2SO4;猜想(2):Na2SO4和____________。
【设计实验】现实验室提供以下试剂:锌粒、铜片、氯化钡溶液、氢氧化钠溶液以及必要的实验仪器,请完成下列表格:
实验操作 | 实验现象 | 实验结论 |
_____________ | _________ | 猜想(2)成立 |
【实验结论】猜想(2)成立
红 等于或小于 H2SO4 取适量甲同学实验反应后的溶液于试管中,加入锌粒,观察现象 锌粒溶解,并有气泡产生 【解析】本题考查了中和反应,酸、碱的化学性质。 Ⅰ、方案l:氢氧化钠溶液显碱性,滴入无色酚酞试液变红色,继续加入稀硫酸,硫酸与氢氧化钠发生中和反应生成硫酸钠和水,当加入的硫酸将氢氧化钠完全中和后,溶液变成无色,得出结论:酸和碱能发生反应; 方案2:溶液pH减小的原因还可能...



 _____________,
_____________, ______________;
______________;