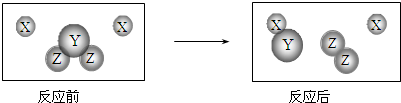
题目内容
6.取12g石灰石(主要成分是CaCO3,杂质不溶于水,也不反应)放入烧杯中,向其中加入100g稀盐酸,二者恰好完全反应,反应结束后,烧杯中剩余物质的总质量为107.6g(气体的溶解忽略不计),求所得的溶液中溶质的质量分数.(结果保留一位小数)分析 根据反应前后的质量差求出生成二氧化碳的质量,根据化学方程式可求得参加反应的碳酸钙的质量和生成的氯化钙的质量,进而求质量分数
解答 解:设参加反应的碳酸钙的质量为x,生成的氯化钙的质量为y,由题意可知,反应后生产二氧化碳12+100-107.6═4.4g
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
$\frac{100}{x}=\frac{111}{y}=\frac{44}{4.4g}$
x=10g,y=11.1g
由题意可知,反应后溶液的质量为107.6-(12-10)═105.6g
反应后氯化钙溶液中氯化钙的质量分数为:$\frac{11.1g}{105.6g}×100%$=10.5%
答:反应后氯化钙溶液中氯化钙的质量分数为10.5%.
点评 根据反应的化学方程式能表示反应中各物质的质量关系,由反应中某物质的质量可计算出反应中其它物质的质量.

练习册系列答案
相关题目
16.下列物质中,由原子直接构成的是( )
| A. | 水 | B. | 氯化钠 | C. | 氮气 | D. | 氦气 |
17.下列物质长时间暴露在空气中,溶液质量增加但不变质的是( )
| A. | 浓盐酸 | B. | 烧碱 | C. | 浓硫酸 | D. | 木炭 |
 如图是A、B两物质的溶解度曲线图,据图可知:
如图是A、B两物质的溶解度曲线图,据图可知: 中国高铁在“一带一路”基础设施的互联互通中扮演着重要的角色.请结合所学知识回答相关问题:
中国高铁在“一带一路”基础设施的互联互通中扮演着重要的角色.请结合所学知识回答相关问题: .
.