题目内容
14.化学是一门以实验为基础的科学.请结合图示回答问题: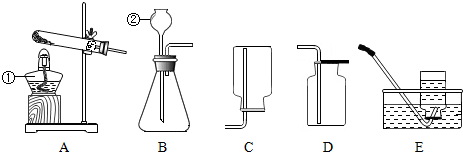
(1)请写出标有序号的仪器名称:①酒精灯;②长颈漏斗.
(2)如果用A、E装置组合制取并收集氧气,实验结束后,应先将导管从水中取出,再熄灭酒精灯,其目的是防止水倒流,使试管炸裂.
(3)实验室制取二氧化碳气体可选用的发生装置是B(填序号),反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.实验中产生的二氧化碳气体中常混有少量的氯化氢气体和水蒸气,某同学利用下图除杂装置,得到了纯净、干燥的二氧化碳气体其中饱和NaHCO3溶液的作用是除去CO2中的HCl气体.
有同学认为只需用NaOH固体便可以把杂质同时除去,你认为是否可行,说明理由:不可行,因为NaOH能与CO2反应.
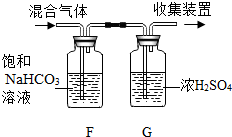
分析 酒精灯是常用的加热仪器,长颈漏斗方便加液体药品;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;实验结束应先移出导管,后熄灭酒精灯,其原因是:防止水倒流,使试管炸裂.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.如图所示.为了得到纯净、干燥的二氧化碳气体其中饱和NaHCO3溶液的作用是:除去CO2中的HCl气体;有同学认为只需用NaOH固体便可以把杂质同时除去,我认为不可行,因为NaOH能与CO2反应.
解答 解:(1)酒精灯是常用的加热仪器,长颈漏斗方便加液体药品,故答案为:酒精灯,长颈漏斗
(2)实验结束应先移出导管,后熄灭酒精灯,其原因是:防止水倒流,使试管炸裂;故答案为:防止水倒流,使试管炸裂,
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.如图所示.为了得到纯净、干燥的二氧化碳气体其中饱和NaHCO3溶液的作用是:除去CO2中的HCl气体;有同学认为只需用NaOH固体便可以把杂质同时除去,我认为不可行,因为NaOH能与CO2反应;故答案为:B;CaCO3+2HCl=CaCl2+H2O+CO2↑;除去CO2中的HCl气体;不可行,因为NaOH能与CO2反应.
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、气体和除杂和干燥等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | CuS04+2NaOH=Cu(OH)2+Na2S04 | B. | 6CO2+6H2O$\frac{\underline{\;光照\;}}{\;}$C6H12O6+6O2↑ | ||
| C. | P+O2$\frac{\underline{\;点燃\;}}{\;}$P2O5 | D. | Fe203+6HCI=2FeCI3+3H20 |
| A. | 尼古丁中碳、氢、氮元素的质量比为5:7:1 | |
| B. | 它是由C、H、N三种元素组成的 | |
| C. | 1个尼古丁分子中共有26个原子 | |
| D. | 尼古丁分子是由碳原子、氢原子、氮原子构成的 |
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH4中是否含有H2 | 将气体点燃 |
| B | 鉴别NaOH溶液和Ca(OH)2溶液 | 分别向溶液中通CO2 |
| C | 除去NaCl中的Na2CO3 | 向其中加入足量稀盐酸 |
| D | 比较铁和铜的活动性顺序 | 将其分别加ZnSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
钠(Na)$\stackrel{O_{2}}{→}$ 钠的氧化物 $\stackrel{H_{2}O}{→}$氢氧化钠溶液 $\stackrel{CO_{2}}{→}$白色固体
[提出问题]:常温下钠与氧气反应,产物有哪些?
[查阅资料]:(1)钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠与过氧化钠都能与水发生反应,其反应的方程式如下:
Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
(2)CaCl2溶液呈中性
[作出猜想]:常温下钠与氧气反应的产物可能为.
猜想1:①Na2O 猜想2:Na2O2,猜想3:Na2O2和NaOH
[实验探究一]:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量钠的氧化物加入足量蒸馏水 | ②固体溶于水,没有气泡生成 | 猜想1正确 |
[作出猜想]生成的白色固体可能是1是:Na2CO3 2是:Na2CO3和NaOH
[实验探究二]:
| 实验操作 | 实验现象 | 实验结论 |
| 1.取少量白色固体配成溶液,加入适量CaCl2溶液 | ③产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
| 2.将上述反应后的溶液过滤,取少量滤液滴加④无色的酚酞试液 | ⑤变成红色 |
1.也可以用稀盐酸区别Na2O与Na2O2,Na2O2与稀盐酸的化学反应方程式为:2Na2O2+4HCl=4NaCl+2H2O+X↑,X的化学式为⑥O2.
2.实验结束后,废液缸中溶液显碱性,请你设计一个实验方案处理废液⑦加适量的酸,将pH调为7.