题目内容
8.现有六种物质:①熟石灰、②活性炭、③干冰、④钛合金.请选择相应物质的序号填空:(1)可用于人工降雨的是③;(2)可用于改良酸性土壤的是①;
(3)能吸附冰箱异味的是②;(4)可用来制造人造骨的是④.
分析 (1)根据干冰升华吸热进行解答;
(2)根据熟石灰属于碱,能和酸发生中和反应进行解答;
(3)根据活性炭具有吸附性进行解答;
(4)根据钛合金与人体具有很好的相容性进行解答.
解答 解:(1)干冰升华吸热,所以干冰可用于人工降雨;
(2)熟石灰属于碱,能和酸发生中和反应,所以可用于改良酸性土壤;
(3)活性炭具有吸附性,能吸附色素和异味,所以活性炭能吸附冰箱异味;
(4)钛合金与人体具有很好的相容性,所以可用来制造人造骨.
故答案为:(1)③;(2)①;(3)②;(4)④.
点评 本题考查内容都是基础知识,但知识点全面,需要同学们掌握好课本内容.

练习册系列答案
相关题目
18.辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质.工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如(图1)所示.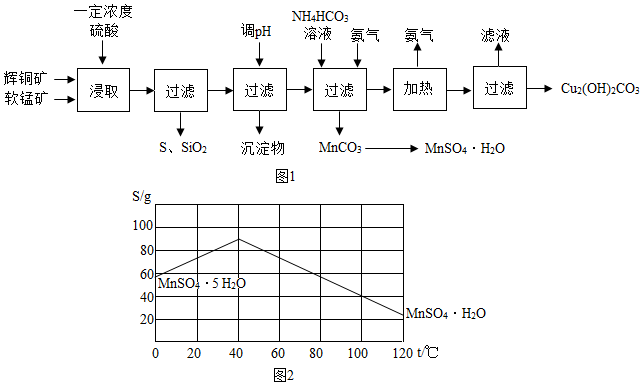
已知:①硫酸、MnO2与Cu2S反应生成硫酸铜、MnSO4和单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如表所示:
(1)酸浸时,为了提高浸取率可采取的措施有矿石粉碎或者适当升高温度或者搅拌(任写一点);酸浸过程中,硫酸、MnO2与Cu2S的化学反应方程式为2MnO2+Cu2S+4H2SO4=2CuSO4+S+4H2O+2MnSO4.
(2)调节浸出液pH的范围为1.1~3.2,其目的是使铁离子转化为氢氧化铁沉淀除去;
(3)本工艺中可循环使用的物质是NH3(写化学式).
(4)NH4HCO3溶液、氨气与MnSO4反应生成MnCO3和一种铵盐,且化学方程式为NH4HCO3+NH3+MnSO4=MnCO3↓+(NH4)2SO4;
(5)碳酸锰可转化为硫酸锰溶液,试根据(如图2)曲线图示,由硫酸锰溶液结晶出MnSO4•H2O的最低温度是
40℃;若由硫酸锰溶液结晶出MnSO4•5H2O的最佳温度是:0℃(上述两个温度均在图中所示范围内选取)

已知:①硫酸、MnO2与Cu2S反应生成硫酸铜、MnSO4和单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如表所示:
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(2)调节浸出液pH的范围为1.1~3.2,其目的是使铁离子转化为氢氧化铁沉淀除去;
(3)本工艺中可循环使用的物质是NH3(写化学式).
(4)NH4HCO3溶液、氨气与MnSO4反应生成MnCO3和一种铵盐,且化学方程式为NH4HCO3+NH3+MnSO4=MnCO3↓+(NH4)2SO4;
(5)碳酸锰可转化为硫酸锰溶液,试根据(如图2)曲线图示,由硫酸锰溶液结晶出MnSO4•H2O的最低温度是
40℃;若由硫酸锰溶液结晶出MnSO4•5H2O的最佳温度是:0℃(上述两个温度均在图中所示范围内选取)
19.如图为空气成分比例图(按体积计算),其中b代表的气体是( )


| A. | 氮气 | B. | 氧气 | C. | 稀有气体 | D. | 二氧化碳 |
16.下列过程中发生了化学变化的是( )
| A. | 金刚石切割玻璃 | B. | 铅笔写字 | ||
| C. | 醋酸清洗热水瓶的水垢 | D. | 浓盐酸稀释 |
13.20℃时,将等质量的a、b两种固体分别加入到盛有100g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙.a、b的溶解度曲线如丙.下列说法正确的是( )


| A. | 图丙中x表示b的溶解度曲线 | |
| B. | 图乙中a、b溶液一定不是饱和溶液 | |
| C. | 30℃时,a、b溶液溶质质量分数不相等 | |
| D. | 图甲中两种溶液的溶质质量分数的大小关系为a>b |

