题目内容
18.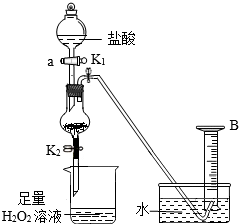 氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,且FeCl3可作H2O2分解的催化剂;同时可测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):
氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,且FeCl3可作H2O2分解的催化剂;同时可测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):操作步骤如下:
Ⅰ.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1、打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeCl3•6H2O晶体.
请回答:
(1)A中发生的置换反应的化学方程式是Fe+2HCl=FeCl2+H2↑.
(2)操作Ⅱ中“…”的内容是当A中固体完全消失,烧杯中的现象是无色溶液逐渐变黄,有气泡产生,相应的化学方程式是2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(3)测得B中所得的气体是V mL(标准状况时),由此计算出该废铁屑中铁的质量分数是$\frac{V}{400m}$,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少.
(4)为了准确测定铁的质量分数,还可以另取mg废铁屑和某种常见的还原剂气体在加热时充分反应到恒重,测得实验后剩余固体质量是wg.由此求出铁的准确质量分数是$\frac{m-\frac{10(m-w)}{3}}{m}$×100%(用含m、和w的式子表示).
分析 (1)铁和盐酸反应生成氢气和氯化亚铁的化学方程式;
(2)装置A中的铁完全消失,反应结束;打开弹簧夹K2,反应生成的氯化亚铁被双氧水氧化成氯化铁,同时有氧气放出;根据氯化亚铁被双氧水氧化、生成的氯化铁作催化剂使双氧水分解情况,写成反应方程式;
(3)“用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体”,氧化铁溶于盐酸,生成的三价铁离子能够消耗铁;
(4)根据质量减少的部分就是氧化铁中氧元素的质量,求出氧化铁的物质的量,再计算出铁的质量分数.
解答 解:(1)铁与盐酸反应的方程式是:Fe+2HCl=FeCl2+H2↑,故答案是:Fe+2HCl=FeCl2+H2↑;
(2)当A中固体完全消失,铁完全和盐酸反应后,反应结束;当A中溶液完全进入烧杯,生成的氯化亚铁被氧化成黄色的氯化铁,生成的氯化铁作催化剂,使双氧水分解,反应的方程式为:答案是:当A中固体完全消失;无色溶液逐渐变黄,有气泡产生;2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑;
(3)由于废铁屑中含有氧化铁,和盐酸反应生成的三价铁离子能够和铁反应,导致铁减少,置换的氢气体积减少,故答案是:Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少;
(4)mg废铁屑中的氧化铁被还原后质量变成wg铁,质量差(m-w)g就是氧化铁中氧元素的质量,设废铁屑中氧化铁的质量为x
Fe2O3~3O
160 48
x (m-w)g
$\frac{160}{48}=\frac{x}{(m-w)g}$
x=$\frac{10(m-w)}{3}g$
铁屑中铁的质量分数为:
$\frac{m-\frac{10(m-w)}{3}}{m}$×100%
故答案为:$\frac{m-\frac{10(m-w)}{3}}{m}$×100%.
点评 本题考查了铁屑中铁的质量分数和制取氯化铁晶体,涉及了较多的化学方程式的书写、质量分数的计算、实验操作等知识,本题难度中等.

| A. | CO2+H2O═H2CO3 | B. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 | ||
| C. | CO2+2KOH═K2CO3+H2O | D. | CO2+CaO$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3 |
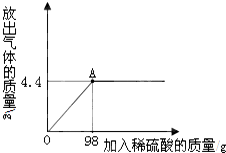 某校化学兴趣小组为了测定某一碳酸钠样品中碳酸钠的质量分数,进行如下实验,取13.25g碳酸钠样品(杂质既不溶于酸也不溶于水)放入烧杯中,加入95.8g水使其完全溶解,再向其中加入稀硫酸,测得反应放出气体的总质量与所加入稀硫酸的质量关系曲线如图所示,请根据题意解答问题:
某校化学兴趣小组为了测定某一碳酸钠样品中碳酸钠的质量分数,进行如下实验,取13.25g碳酸钠样品(杂质既不溶于酸也不溶于水)放入烧杯中,加入95.8g水使其完全溶解,再向其中加入稀硫酸,测得反应放出气体的总质量与所加入稀硫酸的质量关系曲线如图所示,请根据题意解答问题: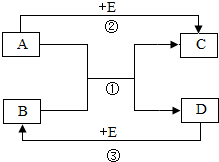 A~E均是初中化学常见的物质,它们的相互转化关系如图所示(反应条件、部分反应物和生成物已略去)
A~E均是初中化学常见的物质,它们的相互转化关系如图所示(反应条件、部分反应物和生成物已略去)
 化学就在我们身边,它与我们的生活息息相关.
化学就在我们身边,它与我们的生活息息相关.