题目内容
16.下列物质的用途,所利用的性质与另外三种有根本区别的是( )| A. | 氢气用于填充气球 | B. | 镁粉用做烟花和照明弹 | ||
| C. | 用活性炭除去冰箱异味 | D. | 铜丝用做电线 |
分析 物质的化学性质是指在化学变化中表现出来的性质,物质的物理性质是指不需要通过化学变化表现出来的性质,据此进行分析判断.
解答 解:A、氢气用于填充气球,是利用了氢气密度比空气小的性质,不需要发生化学变化就能表现出来,是利用了其物理性质.
B、镁粉用作烟花和照明弹,是利用了镁粉燃烧时发出耀眼强光的性质,需要通过化学反应才能表现出来,是利用了其化学性质.
C、用活性炭除去冰箱异味,是利用了活性炭的吸附性,不需要发生化学变化就能表现出来,是利用了其物理性质.
D、铜丝用做电线,是利用了铜的导电性,不需要发生化学变化就能表现出来,是利用了其物理性质.
故B选项所利用的性质与另外三种有根本区别.
故选:B.
点评 本题难度不大,区分物质的用途是利用了物理性质还是化学性质,关键就是看利用的性质是否需要通过化学变化体现出来.

练习册系列答案
相关题目
7.不能用来鉴别CO和CO2的方法是( )
| A. | 通入紫色石蕊试液 | B. | 通入澄清石灰水 | ||
| C. | 闻气味 | D. | 通过灼热的氧化铜 |
4.如图是探究铁制品锈蚀的条件时做的五个实验(铁钉在不同环境中),实验一段时间后,得出的结论错误的是( )


| A. | 乙中铁钉生锈最严重 | |
| B. | 甲、乙、戊中铁钉生锈快慢的顺序为:甲>乙>戊 | |
| C. | 铁生锈的主要条件是与空气、水直接接触 | |
| D. | 丙中的铁钉不生锈 |
11.下列实验现象描述不正确的是( )
| A. | 红磷燃烧产生大量的白烟 | |
| B. | 木炭在空气中燃烧,生成二氧化碳气体 | |
| C. | 硫在空气中燃烧,产生淡蓝色火焰 | |
| D. | 铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 |
 整理、归纳物质性质之间的相互联系,是化学学习的一种有效方法.小丽在复习单质、氧化物、酸、碱、盐性质时,构建了右边知识网络图,图中短线“-”表示相连的两种物质能在一定条件下发生反应.我能帮小丽在单质、氧化物、酸、碱、盐五类物质中分别选取一种物质,将它们的化学式填写在图中圆圈中,并符合以上要求.
整理、归纳物质性质之间的相互联系,是化学学习的一种有效方法.小丽在复习单质、氧化物、酸、碱、盐性质时,构建了右边知识网络图,图中短线“-”表示相连的两种物质能在一定条件下发生反应.我能帮小丽在单质、氧化物、酸、碱、盐五类物质中分别选取一种物质,将它们的化学式填写在图中圆圈中,并符合以上要求.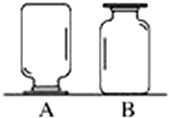 如图,在实验台上放置两瓶气体,集气瓶A、B中盛有二氧化碳(密度比空气的大)、氧气(密度比空气的大)、氢气(密度比空气的小)中的一种.小刚和小强想对瓶中气体进行探究:
如图,在实验台上放置两瓶气体,集气瓶A、B中盛有二氧化碳(密度比空气的大)、氧气(密度比空气的大)、氢气(密度比空气的小)中的一种.小刚和小强想对瓶中气体进行探究: