题目内容
20.某化合物2.3g在空气中完全燃烧后,生成4.4g二氧化碳和2.7g水.对该物质的组成有下列推断:①一定含碳氢元素 ②一定不含氧元素 ③可能含氧元素 ④一定含氧元素 ⑤分子中碳氢的原子个数比为2:5⑥分子中碳、氢、氧元素的质量比为12:3:8.其中正确的是( )
| A. | ①③⑤ | B. | ①④⑥ | C. | ①②⑤ | D. | ①④⑤ |
分析 本题根据有 CO2和 H2O生成,说明有机物一定含有C、H两种元素;氧元素要计算CO2和H2O中C、H两种元素的质量,若质量和小于2.3g,则有氧元素,相等则不含氧元素;然后可进一步计算元素质量比和原子个数比.
解答 解:由题意,反应后 CO2和 H2O生成,有机物一定含有C、H两种元素,则①正确;
CO2中C元素的质量4.4g×$\frac{12}{44}$=1.2g,H2O中H元素的质量2.7g×$\frac{2}{18}$=0.3g,1.2g+0.3g=1.5g<2.3g,说明有氧元素,则②③不正确,④正确;
C、H、O元素的质量比为:1.2g:0.3g:(2.3-1.5)g=12:3:8,则⑥正确;
C、H的原子个数比为:$\frac{1.2g}{12}$:$\frac{0.3g}{1}$=1:3,则⑤不正确.
故选B.
点评 本题根据元素守恒来确定有机物的组成元素,利用定量计算确定氧元素,是有机物成分确定常用的方法.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
10.古代,民间在重阳有登高的风俗,故重阳节又叫“登高节“.在登山过程中,随着高度的上升,下列说法不符合事实的是( )
| A. | 大气密度越来越大 | B. | 大气压强逐渐减小 | ||
| C. | 水的沸点逐渐降低 | D. | 大气中的氧气逐渐稀薄 |
8.图中可用于验证质量守恒定律实验的是( )
| A. |  | B. |  | C. |  | D. |  |
15. 如图趣味小实验:用力上下振荡锥形瓶,可以看到水火相容的现象,停止振荡则火焰熄灭.该实验直接说明燃烧需要( )
如图趣味小实验:用力上下振荡锥形瓶,可以看到水火相容的现象,停止振荡则火焰熄灭.该实验直接说明燃烧需要( )
 如图趣味小实验:用力上下振荡锥形瓶,可以看到水火相容的现象,停止振荡则火焰熄灭.该实验直接说明燃烧需要( )
如图趣味小实验:用力上下振荡锥形瓶,可以看到水火相容的现象,停止振荡则火焰熄灭.该实验直接说明燃烧需要( )| A. | 温度 | B. | 与氧气接触 | ||
| C. | 必须用力上下振荡 | D. | 可燃物 |
12.小金根据生活经验推测,可燃物燃烧可能与氧气和温度有关,并设计完成了下列实验.对比各组实验,哪些组合能够达到研究影响可燃物燃烧因素的目的( )
| 实验① | 实验② | 实验③ | 实验④ |
 |  |  |  |
| 白磷不燃烧 | 白磷不燃烧 | 白磷不燃烧 | 白磷燃烧 |
| A. | ①和②,与温度有关 | B. | ②和③,与氧气有关 | ||
| C. | ②和④,与氧气有关 | D. | ①和④,与氧气和温度有关 |
10.甲原子与乙原子的质量比为a:b,而乙原子与碳12原子的质量比为c:d,则甲原子的相对原子质量为( )
| A. | 12ac/bd | B. | bc/12ac | C. | 12bd/ac | D. | ab/12bc |
 如图是水分子分解示意图,请你写出获得的化学信息.(写3出点)
如图是水分子分解示意图,请你写出获得的化学信息.(写3出点)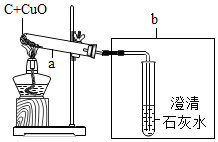 某化学兴趣小组的同学探究木炭还原氧化铜的实验,实验装置如图.实验时,a中的固体由黑色变红色,b中的试管内产生气泡和白色沉淀.
某化学兴趣小组的同学探究木炭还原氧化铜的实验,实验装置如图.实验时,a中的固体由黑色变红色,b中的试管内产生气泡和白色沉淀.