题目内容
6.(1)氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源,反应的化学方程式为:LiH+H2O═LiOH+H2↑.计算80g氢化锂与足量的水反应生成氢气的质量?(2)请根据如图所示的实验过程和提供的数据,计算样品中钠元素的质量?

分析 碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断.
解答 解:(1)设生成氢气质量为x,
LiH+H2O═LiOH+H2↑,
8 2
80g x
$\frac{8}{80g}=\frac{2}{x}$,
x=20g,
答:80g氢化锂与足量的水反应生成氢气的质量是20g.
(2)设碳酸钠质量为y,
反应生成碳酸钙沉淀质量为:22.3g+100.0g+86.1g-198.4g=10g,
Na2CO3+CaCl2═CaCO3↓+2NaCl,
106 100
y 10g
$\frac{106}{y}=\frac{100}{10g}$,
x=10.6g,
样品中钠元素的质量为:10.6g×$\frac{46}{106}$×100%+(22.3g-10.6g)×$\frac{23}{58.5}$×100%=9.2g,
答:样品中钠元素的质量为9.2g.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.

练习册系列答案
相关题目
16.下列是生活中常见物质的pH,能使酚酞溶液变红的物质是( )
| A. | 柠檬汁2.4 | B. | 酱油4.6 | C. | 食盐水7.0 | D. | 炉具清洁剂12.5 |
17.如表说明甲、乙、丙、丁四种液体之性质,小仕取其中一种液体与蒸馏水加入试管中,在室温下,充分搅拌后静置一段时间,试管内的情况如图所示.则小仕所取的液体为何者( )

| 液体 | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 与蒸馏水作用 |
| 甲 | 0.78 | -9.7 | 65 | 可互相溶解 |
| 乙 | 0.8 | 6.4 | 81 | 不可互相溶解 |
| 丙 | 1.15 | -5.2 | 218 | 不可互相溶解 |
| 丁 | 1.3 | 12.5 | 290 | 可互相溶解 |
| A. | 甲 | B. | 乙 | C. | 丙 | D. | 丁 |
1.下列所示的图象能反映相对应实验的是( )
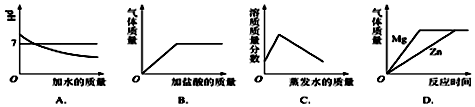

| A. | 向pH=12的石灰水中不断加水稀释 | |
| B. | 向碳酸钙固体中逐滴加入稀盐酸至过量 | |
| C. | 在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出 | |
| D. | 将等质量的金属镁和锌分别和足量相同质量分数的稀硫酸混合 |
15.推理是一种重要的学习方法.下列推理中正确的是( )
| A. | 分子、原子都是不带电的微粒,但不带电的微粒不一定都是分子、原子 | |
| B. | 物质与氧气发生的反应都是氧化反应,则氧化反应一定要有氧气参加 | |
| C. | 单质是由一种元素组成的物质,则由一种元素组成的物质一定是单质 | |
| D. | 酸碱盐之间的复分解反应一定有盐生成,则有盐生成的反应一定是酸碱盐之间的复分解反应 |
16.某混合气体可能含有CO、CO2、H2和H2O(气)中的一种或几种.为验证其组成,同学们进行实验的装置和现象如下(夹持仪器已省略,假设气体均吸收完全).

(1)仪器a的名称是锥形瓶.
(2)装置D中溶液变浑浊的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O.
(3)丁认为,由于他们对装置A中的实验现象分析不同而导致结论有差异.根据碳酸盐可转变为CO2的性质,丁利用上述实验结束后装置内药品和某种常见试剂进行实验,证明了甲的结论是正确的.请写出丁的实验操作过程与现象.

| 结论 | 甲 | 乙 | 丙 |
| 含有CO、H2、H2O(气) | 含有CO、H2、CO2 | 含有C0、H2、C02、H20(气) |
(2)装置D中溶液变浑浊的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O.
(3)丁认为,由于他们对装置A中的实验现象分析不同而导致结论有差异.根据碳酸盐可转变为CO2的性质,丁利用上述实验结束后装置内药品和某种常见试剂进行实验,证明了甲的结论是正确的.请写出丁的实验操作过程与现象.

 某科学小组用实验室中NaOH溶液测定空气中酸性气体(CO2、SO2)的体积分数.实验步骤如下:
某科学小组用实验室中NaOH溶液测定空气中酸性气体(CO2、SO2)的体积分数.实验步骤如下: