题目内容
12.小明参观某养鱼池时,好奇的发现农民向养鱼池中撒一种淡黄色固体--过氧化钙,用来增加鱼池中的含氧量.小明刚学完氧气的实验室制法,于是他想可否用过氧化钙制取氧气.
【提出问题】过氧化钙可否用于制取氧气?
【查阅资料】部分内容如下:过氧化钠与水反应的原理:
Na2O2+H2O→NaOH+O2,且CaO2与Na2O2的化学性质非常相似.请写出CaO2与H2O反应的化学方程式2CaO2+2H2O=2Ca(OH)2+O2↑.
过氧化钙(CaO2)室温下稳定,在300℃时分解生成氧气,主要用途可做增氧剂、杀菌剂等.
【猜想与验证】
(1)小明依据资料显示:加热过氧化钙可制取氧气.
实验主要过程:
①检查装置气密性.操作如下:先将导管伸入液面下,用手紧握试管,观察到导管口有气泡冒出,松开手后,导管口有液面上升.
②加入过氧化钙,加热,当导管口气泡连续均匀冒出时,开始收集氧气.
③收集满一瓶气体,并将集气瓶正放在桌上.
④停止加热.熄灭酒精灯前,应将导管移出水面.
⑤检验气体.方法是将一根带火星的木条靠近集气瓶口,如果木条复燃,说明该瓶内的气体是氧气.
实验结论:加热过氧化钙可制取氧气.
(2)小明联想到农民用过氧化钙增加鱼池中的含氧量,提出猜想Ⅱ.
猜想Ⅱ:过氧化钙与水反应可制取氧气.
实验主要过程:
①检查装置气密性.
②加入过氧化钙和水后,有少量细小气泡缓慢放出.
③在导管口几乎收集不到气体.该装置放置到第二天,集气瓶中只收集到极少量气体,振荡试管后仍有少量细小气泡缓慢放出.
实验结论:不能用过氧化钙与水反应制取氧气.
分析与反思:
虽然没有快速收集到大量氧气,但由此实验现象,小明推导出农民用过氧化钙做增氧剂的主要原因是过氧化钙在水中持续、缓慢放出氧气,所以可以作为增氧剂.
(3)小明希望对此实验进行改进,使该反应加快,你能帮他提出建议吗?
你的合理建议:加热过氧化钙和水的混合物.这些建议是否可行,还需进一步通过实验验证.
分析 【查阅资料】首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.
(1)根据资料可知过氧化钙(CaO2)室温下稳定,在300℃时分解成氧气,提出相应的猜想加热过氧化钙制氧气;
实验过程和加热固体制取氧气相同.
(2)根据实验现象,过氧化钙在水中反应的速度慢,持续的时间长,进行分析解答;
(3)根据过氧化钙(CaO2)室温下稳定,在300℃时分解成氧气,由此可知加热过氧化钙和水的混合物有可能会使反应加快进行分析解答.
解答 解:【查阅资料】由题意进行类别,CaO2与H2O反应生成氢氧化钙和氧气,反应的化学方程式为:2CaO2+2H2O=2Ca(OH)2+O2↑.
故填:2CaO2+2H2O=2Ca(OH)2+O2↑.
(1)①根据检查装置气密性的方法是:将导管插入水中,手握住试管,如果导管口有气泡冒出,松开手后,导管内有一段上升液柱,说明该装置气密性良好,证明不漏气;
故答案为:导管口有气泡冒出;
②当导管口气泡连续均匀冒出时,开始收集氧气,以防收集的氧气不纯.
故答案为:导管口气泡连续均匀冒出时;
⑤检验氧气集满的方法是:将一根带火星的木条靠近集气瓶口,如果木条复燃,说明该瓶内的气体是氧气,
故答案为:将一根带火星的木条靠近集气瓶口,如果木条复燃,说明该瓶内的气体是氧气;
(2)由过氧化钙与水反应,该反应缓慢,不适合在实验室制氧气,但可做鱼池增氧剂,若加快反应,可加热或用催化剂.
故答案为:过氧化钙在水中持续、缓慢放出氧气,所以可以作为增氧剂;
(3)若加快反应,可加热或用催化剂.
故答案为:加热过氧化钙和水的混合物(或向过氧化钙和水的混合物中加入催化剂).
点评 此类题能训练学生的思维,具有知识的迁移作用,学生在利用所学知识进行猜想验证的过程就是学习过程.

| A. | 氧气,稀有气体 | B. | 冰水混合物,食盐水 | ||
| C. | 二氧化碳,液氧 | D. | 澄清石灰水,高锰酸钾 |
| 选项 | 实验设计 | 现象 | 结论 |
| A | 分别将形状、大小相同的铜丝和银丝放入相同浓度的稀盐酸中 | 铜的表面有气泡产生,银没有 | Cu>Ag |
| B | 分别将质量相同的铝丝和镁片引燃,插入盛有氧气的集气瓶中 | 镁比铝燃烧得更剧烈 | Mg>Al |
| C | 将铁丝插入硫酸铜溶液中 | 铁丝表面变红 | Cu>Fe |
| D | 分别将形状、大小相同的锌片、铁片放入相同浓度的稀硫酸中 | 锌片比铁片产生气泡的速率更快 | Zn>Fe |
| A. | A | B. | B | C. | C | D. | D |
| A. | 饱和溶液一定是浓溶液 | |
| B. | 饱和溶液可以通过升温变成不饱和溶液 | |
| C. | 汽油去油漆是溶解现象 | |
| D. | 原子一定不可分 |
 实验室可用如图所示装置来测定空气中氧气的含量.实验时可观察到:当红磷在集气瓶中燃烧停止后,集气瓶内水面上升大约$\frac{1}{5}$体积.请你回答:
实验室可用如图所示装置来测定空气中氧气的含量.实验时可观察到:当红磷在集气瓶中燃烧停止后,集气瓶内水面上升大约$\frac{1}{5}$体积.请你回答:(1)集气瓶内水面上升约$\frac{1}{5}$体积,由此你得到的结论是:氧气约占空气总体积的五分之一.
(2)实验中的红磷需要稍微过量,目的是完全消耗瓶内氧气.请写出红磷燃烧这一反应的(文字或符号)表达式:磷+氧气$\stackrel{点燃}{→}$五氧化二磷.
(3)通过这个实验,我们还可以认识氮气的一些性质.请将你的分析结果填在如表
的横线上.
| 实 验 现 象 | 分 析 结 果(即氮气的性质) |
| ①燃烧着的红磷慢慢熄灭了 | 氮气不支持燃烧 |
| ③集气瓶内的水面上升一定高度后不再上升 | 氮气不易溶于水 |

| A. | 一个水分子由两个氢原子和一个氧原子构成 | |
| B. | 水分解后生成氢气和氧气的分子数比为2:1 | |
| C. | 水分解过程中,原子的数目不变 | |
| D. | 水分解过程中,分子的种类不变 |
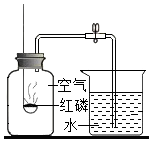 已知空气的主要成份是氮气和氧气.某课外活动小组 设计了测定空气中氧气含量的实验:在燃烧匙内盛过量红磷,点燃后立即插入充满空气的集气瓶中,塞紧橡皮塞,等红磷火焰熄灭,集气瓶冷却至室温后,再打开水夹.实验装置如图:
已知空气的主要成份是氮气和氧气.某课外活动小组 设计了测定空气中氧气含量的实验:在燃烧匙内盛过量红磷,点燃后立即插入充满空气的集气瓶中,塞紧橡皮塞,等红磷火焰熄灭,集气瓶冷却至室温后,再打开水夹.实验装置如图: 水是一种重要的资源,我们生活中最常用到的是水.
水是一种重要的资源,我们生活中最常用到的是水.