题目内容
10.将3g的镁条在给定的氧气中充分燃烧,实验数据如下.| 实验次数 | 1 | 2 | 3 |
| 给定氧气的质量(g) | 3 | 2 | 1 |
| 生成氧化镁的质量(g) | 5 | 5 | 2.5 |
(1)第2次实验中镁条与氧气恰好完全反应;
(2)第3次实验中镁条有剩余,剩余1.5g;
(3)第1次实验中氧气有剩余,剩余1g;
(4)是否有不符合质量守恒定律的(如果有请填实验序号,如果没有请填“没有”)没有.
分析 根据碳和氧气反应生成二氧化碳的反应中碳和氧气的质量比(或质量守恒定律)判断那一次反应恰好完成,并依据该方程式可计算不完全反应时过量物质的剩余质量,由于化学反应一定符合质量守恒定律,故可判断那些组合符合质量守恒定律.
解答 解:镁与氧气反应的方程式为2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO可知该反应中镁与氧气及氧化镁的质量比为:48:16×2:80=3:2:5;
(1)参加反应的各物质质量总与反应生成物质质量总和相等,符合这一要求的只有第二次实验,所以此次实验中两种物质恰好完全反应;
(2)由于第三次实验中氧气只有1g不足,所以镁会有剩余;剩余镁的质量=3g-(2.5g-1g)=1.5g;
(3)由于第一次反应中氧化镁的质量是5g,所以反应的氧气量是2g,则剩余氧气质量=3g-2g=1g;
(4)由于任何化学反应一定符合质量守恒定律,故1、2、3均符合质量守恒定律;
故答案为:(1)2;(2)3;1.5;(3)1;1;(4)没有.
点评 所有的化学反应均符合质量守恒定律,所以化学反应中物质的质量比是固定不变的.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
1.制造下列物质时,不需要用石灰石作原料的是( )
| A. | 生铁 | B. | 生石灰 | C. | 水泥 | D. | 钢 |
15.下列化学用语中的“2”能表示“2个原子”的是( )
| A. | 2H | B. | 2H2 | C. | 2Na+ | D. | $\stackrel{+2}{Mg}$ |
19.为减少污染、提高煤的利用率,可将其转化为可燃性气体,其微观示意图如下所示:

下列说法正确的是( )

下列说法正确的是( )
| A. | 该反应中涉及两种氧化物 | |
| B. | 该反应类型为化合反应 | |
| C. | 该反应中反应物两种分子的个数比为3:1 | |
| D. | 反应前后物质的种类保持不变 |
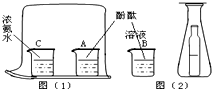 以图(1)和图(2)是两个设计证明分子运动的实验.在图(2)的锥形瓶中的小瓶里装着浓氨水,锥形瓶口用一张滤纸盖住,滤纸刚刚用酚酞溶液浸过.
以图(1)和图(2)是两个设计证明分子运动的实验.在图(2)的锥形瓶中的小瓶里装着浓氨水,锥形瓶口用一张滤纸盖住,滤纸刚刚用酚酞溶液浸过.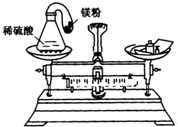 物质发生化学变化的前后,总质量是否发生了改变?请你和小明按下面的过程一起探究:
物质发生化学变化的前后,总质量是否发生了改变?请你和小明按下面的过程一起探究: