题目内容
18.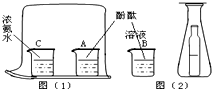 以图(1)和图(2)是两个设计证明分子运动的实验.在图(2)的锥形瓶中的小瓶里装着浓氨水,锥形瓶口用一张滤纸盖住,滤纸刚刚用酚酞溶液浸过.
以图(1)和图(2)是两个设计证明分子运动的实验.在图(2)的锥形瓶中的小瓶里装着浓氨水,锥形瓶口用一张滤纸盖住,滤纸刚刚用酚酞溶液浸过.(1)图(2)中观察到的现象是锥形瓶口滤纸变成红色.
(2)图(1)中观察到的现象是A烧杯中的酚酞溶液变红,
可以得到的结论是分子是不断运动的.
(3)在图(1)中的大烧杯外放一杯酚酞溶液的目的是对照实验,证明空气不能使酚酞溶液变红.
(4)请你就两个实验的操作过程、药品用量、以及实验的严密性或其它方面作出比较性的评价:图(1):操作复杂,药品用量多,观察时间较长,严密性强.图(2):图(2)所用仪器较少,操作简单,节约了药品.
分析 根据用浓氨水来验证微粒是不断运动的这一基本特征是化学上很经典的一个实验,其原理是浓氨水具有挥发性,挥发出来的氨气能比较快地运动到含有无色酚酞试液的烧杯中进行解答.
解答 解:无色酚酞试液是一种常用的酸碱指示剂,具有遇碱性物质变红的特性.浓氨水具有挥发性,挥发出来的氨气易溶于水形成的溶液显碱性.由设计的实验来看,图(1)在设计的实验比较严密,如在大烧杯外放置一装有无色酚酞试液的烧杯与大烧杯内的无色酚酞试液形成对比,而图(2)设计的实验符合微型化的特征,用到的仪器比较少又节约了药品.
故答案为:
(1)锥形瓶口滤纸变成红色;
(2)A烧杯中的酚酞溶液变红;
(4)图(2)所用仪器较少,操作简单,节约了药品.
点评 用浓氨水和无色酚酞试液来验证微粒是不断运动的特征,具有时间短,现象明显的优点.在实验设计上要结合考虑影响的因素,设计相应的对比实验.

练习册系列答案
相关题目
8.氧气是一种化学性质比较活泼的气体,能和许多物质发生化学反应.如:①硫+氧气$\frac{点燃}{\;}$二氧化硫②磷+氧气$\frac{点燃}{\;}$五氧化二磷③镁+氧气$\frac{点燃}{\;}$氧化镁,叙述中不正确的是( )
| A. | 都需要点燃 | B. | 都生成氧化物 | ||
| C. | 都属于化合反应 | D. | 都是非金属跟氧气反应 |
9.下列符号不具有宏观意义,而只有微观意义的是( )
| A. | Cu | B. | 3O | C. | H2 | D. | O |
6.氧气是空气的主要成分之一,有关氧气的说法错误的是( )
| A. | 用带火星的木条可以检验氧气 | |
| B. | 用加热高锰酸钾的方法可以制取氧气 | |
| C. | 鱼类能生活在水中,证明氧气易溶于水 | |
| D. | 镁能在空气中燃烧,发出耀眼的白光,生成白色固体 |
13.某不纯铁块5.6g与足量盐酸反应得0.18g H2,则铁块中含有的杂质不可能是( )
| A. | 银 | B. | 铝 | C. | 铜 | D. | 锌 |
10.将3g的镁条在给定的氧气中充分燃烧,实验数据如下.
从以上数据分析,在这三次实验中(填序号)
(1)第2次实验中镁条与氧气恰好完全反应;
(2)第3次实验中镁条有剩余,剩余1.5g;
(3)第1次实验中氧气有剩余,剩余1g;
(4)是否有不符合质量守恒定律的(如果有请填实验序号,如果没有请填“没有”)没有.
| 实验次数 | 1 | 2 | 3 |
| 给定氧气的质量(g) | 3 | 2 | 1 |
| 生成氧化镁的质量(g) | 5 | 5 | 2.5 |
(1)第2次实验中镁条与氧气恰好完全反应;
(2)第3次实验中镁条有剩余,剩余1.5g;
(3)第1次实验中氧气有剩余,剩余1g;
(4)是否有不符合质量守恒定律的(如果有请填实验序号,如果没有请填“没有”)没有.
8.某兴趣小组同学对6g氯酸钾和二氧化锰的混合物进行研究.依次加热该混合物t1、t2、t3、t4时间,再冷却后称量剩余物质质量,记录有关数据如下表(样品中的杂志不参加反应):
(1)加热过程中发生反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(2)加热过程中,剩余固体质量变小的原因是氯酸钾分解生成的氧气逸出;加热至t3时间后,剩余固体的质量不在改变,其原因是加热至t3时间后,氯酸钾已经完全分解.
| 加热时间/min | t1 | t2 | t3 | t4 |
| 剩余固体的质量/g | 4.24 | 4.16 | 4.08 | 4.08 |
(2)加热过程中,剩余固体质量变小的原因是氯酸钾分解生成的氧气逸出;加热至t3时间后,剩余固体的质量不在改变,其原因是加热至t3时间后,氯酸钾已经完全分解.