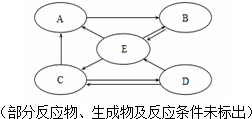
题目内容
13.海水晒盐得到的食盐水中常常含有氯化钙、氯化镁、硫酸钠等杂志.某同学设计如图流程提纯氯化钠(①②③步所加试剂均过量):
依据以上信息回答:
(1)写出过滤操作中用到的所有主要的玻璃仪器.
(2)步骤②中加入氯化钡溶液后,混合物中的溶质共有4种,
(3)如何判断步骤⑤中所加稀盐酸己经适量?
分析 (1)根据在过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒进行分析;
(2)根据氢氧化钠和氯化镁反应会生成氯化钠和氢氧化镁沉淀,氯化钡和硫酸钠会生成硫酸钡沉淀和氯化钠进行分析;
(3)根据碳酸钠和盐酸反应会生成二氧化碳气体进行分析.
解答 解:(1)在过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(2)氢氧化钠和氯化镁反应会生成氯化钠和氢氧化镁沉淀,氯化钡和硫酸钠会生成硫酸钡沉淀和氯化钠,所以步骤②中加入氯化钡溶液后,混合物中的溶质有氯化钠、氢氧化钠、氯化钡、氯化钙4种;
(3)碳酸钠和盐酸反应会生成二氧化碳气体,所以判定操作Ⅲ加入盐酸达到适量的方法是:滴加盐酸至溶液恰好没有气泡产生.
故答案为:(1)烧杯、漏斗、玻璃棒;
(2)4;
(3)滴加盐酸至溶液恰好没有气泡产生.
点评 本题主要考查了粗盐提纯时的物质的除杂和净化,在除杂质时不要引入新的杂质,了解混合物的分离和除杂的方法是解答本题的基础知识.

练习册系列答案
相关题目
3.FeCl3可用作催化剂和外伤止血剂.某实验兴趣小组利用FeCl3腐蚀电路铜板后的溶液(主要成分为FeCl2、CuCl2)进行了氯化铁回收实验.该实验小组同学通过查阅资料,进行了尝试.
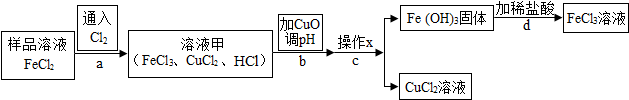
【阅读资料】
不同金属氢氧化物可以在不同pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离.如表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
(1)操作x是过滤.
(2)实验中,步骤b加入 CuO 消耗 溶液甲中的HCl,使溶液pH增大到所需范围,请写出盐酸与氧化铜反应的化学方程式CuO+2HCl=CuCl2+H2O;该反应属于复分解反应(填基本反应类型).你认为步骤b调节溶液的pH到3.2~4.7(填数值范围)比较合适.
(3)实验中,步骤d加稀盐酸前,因缺少洗涤(填操作名称)而使获得的氯化铁溶液不纯.
(4)FeCl3溶液容易生成Fe( OH ) 3 发 生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用C(用字母表示)最合理.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.

【阅读资料】
| Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀的pH | 1.9 | 4.7 |
| 沉淀完全的pH | 3.2 | 6.7 |
(1)操作x是过滤.
(2)实验中,步骤b加入 CuO 消耗 溶液甲中的HCl,使溶液pH增大到所需范围,请写出盐酸与氧化铜反应的化学方程式CuO+2HCl=CuCl2+H2O;该反应属于复分解反应(填基本反应类型).你认为步骤b调节溶液的pH到3.2~4.7(填数值范围)比较合适.
(3)实验中,步骤d加稀盐酸前,因缺少洗涤(填操作名称)而使获得的氯化铁溶液不纯.
(4)FeCl3溶液容易生成Fe( OH ) 3 发 生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用C(用字母表示)最合理.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.
1.化学与生活密切相关.下列食物每天为人体提供60%~70%能量的是 ( )
| A. | 馒头 | B. | 纯牛奶 | C. | 花生 | D. | 胡萝卜 |
18.中科院上海硅酸盐研究所己成功合成出羟基磷灰石“耐火纸”,可耐1000℃以上高温具有高柔柔韧性.可任意卷曲,不可燃烧,羟基磷灰石的化学式为Ca10(PO4)6(OH)2,下列有关说法不正确的是( )
| A. | 羟基磷灰石是无机物 | |
| B. | 这种耐火抵可作为阻燃材料和耐高温材料等 | |
| C. | 羟基磷灰石中氢、氧元素质量比为1:208 | |
| D. | 羟基磷灰石中含有10年钙原子,2个氢原子,26个氧原子,6个磷原子. |
5.下列物质不属于空气污染物的是( )
| A. | 一氧化碳 | B. | 烟尘 | C. | 二氧化碳 | D. | 二氧化硫 |
2.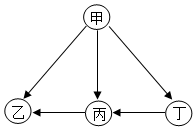 现有甲、乙、丙、丁四种金属,采用将其中的一种金属分别放入另外三种金属的硝酸盐溶液中的方法进行实验,得到四种金属间的转化关系(如图所示).则四种金属的活动性由强到弱的顺序是( )
现有甲、乙、丙、丁四种金属,采用将其中的一种金属分别放入另外三种金属的硝酸盐溶液中的方法进行实验,得到四种金属间的转化关系(如图所示).则四种金属的活动性由强到弱的顺序是( )
 现有甲、乙、丙、丁四种金属,采用将其中的一种金属分别放入另外三种金属的硝酸盐溶液中的方法进行实验,得到四种金属间的转化关系(如图所示).则四种金属的活动性由强到弱的顺序是( )
现有甲、乙、丙、丁四种金属,采用将其中的一种金属分别放入另外三种金属的硝酸盐溶液中的方法进行实验,得到四种金属间的转化关系(如图所示).则四种金属的活动性由强到弱的顺序是( )| A. | 甲、乙、丙、丁 | B. | 甲、丁、丙、乙 | C. | 乙、丙、丁、甲 | D. | 丁、丙、乙、甲 |