题目内容
废金属的回收利用
废金属主要是指冶金工业、金属加工业和日常生活中丢弃的金属_________、_________、_________、_________等,废金属不但造成_________,还会形成_________ 、_________等对环境造成污染。目前,全球钢产量的_________和铜产量的_________是通过对废金属冶炼完成的。
答案:碎屑 碎块 锈蚀 报废的金属物品 资源浪费 镉 汞 45% 40%
从公元1世纪起,铁便成了我国主要的金属,历史上遗留下来的铜制品比比皆是,但铁制文物却很少,中国古代采用铜制成大量铜钱用于流通,却不用铁来铸币,试分析原因。
剖析:能够留下的古代艺术品多为金、银、铜制金属制品,因为它们活跃性差,不易被腐蚀。所以古代铸造钱币多用铜、银和金,而铁易于被腐蚀,虽然应用广泛,但却难以长期保存。

练习册系列答案
相关题目
绿矾(FeSO4?7H2O)、硫酸亚铁铵(FeSO4?(NH4)2SO4?6H2O)是重要的化学化工试剂.工业上常利用机械加工行业产生的废铁屑为原料制备.这种废铁屑中常混有FeS(其它杂质忽略不计),与稀硫酸反应为:FeS+H2SO4=FeSO4+H2S↑,H2S有毒,水溶液名称为氢硫酸.
请回答下列问题:
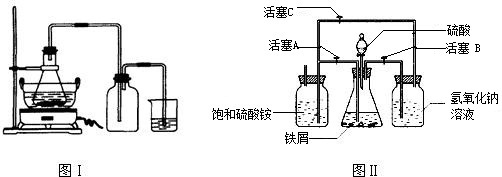
(1)图Ⅰ用于制备绿矾.锥形瓶中反应产生绿矾,其中盛放的药品或原料是 ,发生的反应除前述化学方程式外,还一定有 (写化学方程式): .
若知集气瓶的作用是作安全瓶,烧杯中发生的反应是:CuSO4+H2S=CuS↓+H2SO4,则烧杯中盛放的试剂是 ,其作用为 .
(2)图Ⅱ用于制备硫酸亚铁铵(已知亚铁盐容易被氧化).在0~60℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,所以硫酸亚铁与硫酸铵的混合溶液冷却至室温便析出硫酸亚铁铵.
具体操作:①打开活塞 ,关闭活塞 ,从 (填仪器名称)中滴下稀H2SO4到250mL规格的锥形瓶中,充分反应.②待锥形瓶中的铁屑快反应完时,关闭活塞 ,打开活塞 .③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
实验中氢气的作用是 ,
氢氧化钠溶液的作用是 .
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁铵,并对产品质量进行检测.检测结果如下:
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制 过量为最佳.
(4)处理胶片的废液中含大量AgNO3、Zn(NO3)2和Fe(NO3)2,若随意排放不仅会造成严重的污染,而且造成资源浪费.某同学从上述的废液中回收金属银并得到副产品绿矾(FeSO4?7H2O),其回收流程如下:
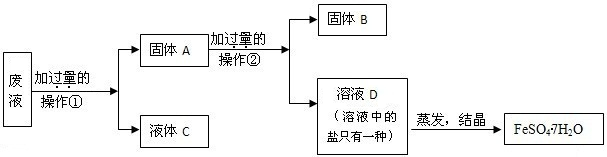
操作②是 ,固体A中含 ,固体B是 ,
x是 ,y是 ,x、y过量的共同作用是 .
(5)硫酸最古老的生产方法是:把绿矾(FeSO4?7H2O)装入反应器中加强热,会流出油状液体,并放出有刺激性气味的气体(SO2),反应器中的固体变为红色.这个变化的过程可用两个化学方式表示.
① .
② .

请回答下列问题:
(1)图Ⅰ用于制备绿矾.锥形瓶中反应产生绿矾,其中盛放的药品或原料是
若知集气瓶的作用是作安全瓶,烧杯中发生的反应是:CuSO4+H2S=CuS↓+H2SO4,则烧杯中盛放的试剂是
(2)图Ⅱ用于制备硫酸亚铁铵(已知亚铁盐容易被氧化).在0~60℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,所以硫酸亚铁与硫酸铵的混合溶液冷却至室温便析出硫酸亚铁铵.
具体操作:①打开活塞
实验中氢气的作用是
氢氧化钠溶液的作用是
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁铵,并对产品质量进行检测.检测结果如下:
| 序号 | 反应物用量(n表示微粒个数) | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于1级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于1级 |
(4)处理胶片的废液中含大量AgNO3、Zn(NO3)2和Fe(NO3)2,若随意排放不仅会造成严重的污染,而且造成资源浪费.某同学从上述的废液中回收金属银并得到副产品绿矾(FeSO4?7H2O),其回收流程如下:

操作②是
x是
(5)硫酸最古老的生产方法是:把绿矾(FeSO4?7H2O)装入反应器中加强热,会流出油状液体,并放出有刺激性气味的气体(SO2),反应器中的固体变为红色.这个变化的过程可用两个化学方式表示.
①
②
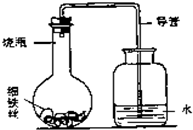 对生活中常见金属的有关问题探究:
对生活中常见金属的有关问题探究:
人类从石器时代进入青铜器时代,继而进入铁器时代;前两个世纪中钢铁产量是衡量国家工业和经济发展的标志.可见金属材料长期以来一直被广泛地应用着.对金属材料的探究要用到许多化学知识.
(1)“金属之最”:完成(1)~(2)的空格,并以此为例,再另外写出两个“金属之最”.
①目前世界上年产量最高的金属是______;
②地壳中含量最多的金属是______;
③______;④______.
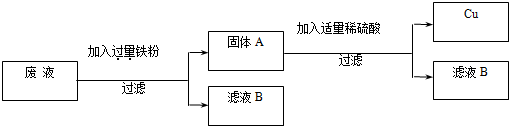
(2)“变废为宝,回收利用”:某厂的废液中含有H2SO4和CuSO4,为了防止废酸和CuSO4污染环境,厂家设计用含铁的废弃物回收金属铜,同时生产重要的化工原料硫酸亚铁晶体,设计原理如图所示:
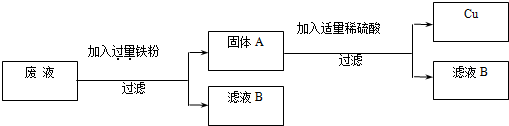
请你根据上述设计方案写出有关化学方程式:______;______.
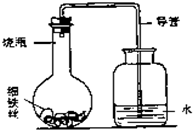
(3)“锈蚀条件的探究”:某学生在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
| 时间/小时 | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| A瓶(盛干燥铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| B瓶(盛沾了食盐水的铁丝) | 0 | 0.4 | 1.2 | 3.4 | 5.6 | 7.6 | 9.8 |
| C瓶(盛沾了清水的铁丝) | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
| D瓶(盛完全浸没在食盐水中的铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
②上述实验中,铁生锈的速率由大到小的排列顺序为(填小烧瓶号):______.
③影响铁生锈的因素有:______.
(4)“金属的防护”:对如何防止你的自行车的钢圈生锈提出两种方案.______.
(5)“金属的冶炼”:某钢铁厂日产含4%杂质的生铁2240吨.问:需要含Fe2O3质量分数为80%的赤铁矿石多少吨?
对生活中常见金属的有关问题探究:
人类从石器时代进入青铜器时代,继而进入铁器时代;前两个世纪中钢铁产量是衡量国家工业和经济发展的标志.可见金属材料长期以来一直被广泛地应用着.对金属材料的探究要用到许多化学知识.
(1)“金属之最”:完成(1)~(2)的空格,并以此为例,再另外写出两个“金属之最”.
①目前世界上年产量最高的金属是______;
②地壳中含量最多的金属是______;
③______;④______.
(2)“变废为宝,回收利用”:某厂的废液中含有H2SO4和CuSO4,为了防止废酸和CuSO4污染环境,厂家设计用含铁的废弃物回收金属铜,同时生产重要的化工原料硫酸亚铁晶体,设计原理如图所示:
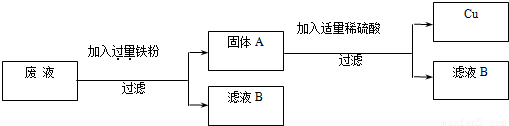
请你根据上述设计方案写出有关化学方程式:______;______.
(3)“锈蚀条件的探究”:某学生在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
①导管中水面为什么会上升?______.
②上述实验中,铁生锈的速率由大到小的排列顺序为(填小烧瓶号):______.
③影响铁生锈的因素有:______.
(4)“金属的防护”:对如何防止你的自行车的钢圈生锈提出两种方案.______.
(5)“金属的冶炼”:某钢铁厂日产含4%杂质的生铁2240吨.问:需要含Fe2O3质量分数为80%的赤铁矿石多少吨?
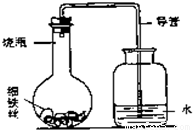
人类从石器时代进入青铜器时代,继而进入铁器时代;前两个世纪中钢铁产量是衡量国家工业和经济发展的标志.可见金属材料长期以来一直被广泛地应用着.对金属材料的探究要用到许多化学知识.
(1)“金属之最”:完成(1)~(2)的空格,并以此为例,再另外写出两个“金属之最”.
①目前世界上年产量最高的金属是______;
②地壳中含量最多的金属是______;
③______;④______.
(2)“变废为宝,回收利用”:某厂的废液中含有H2SO4和CuSO4,为了防止废酸和CuSO4污染环境,厂家设计用含铁的废弃物回收金属铜,同时生产重要的化工原料硫酸亚铁晶体,设计原理如图所示:

请你根据上述设计方案写出有关化学方程式:______;______.
(3)“锈蚀条件的探究”:某学生在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
| 时间/小时 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | |
| A瓶(盛干燥铁丝) | |||||||
| B瓶(盛沾了食盐水的铁丝) | 0.4 | 1.2 | 3.4 | 5.6 | 7.6 | 9.8 | |
| C瓶(盛沾了清水的铁丝) | 0.3 | 0.8 | 2.0 | 3.5 | |||
| D瓶(盛完全浸没在食盐水中的铁丝) |
②上述实验中,铁生锈的速率由大到小的排列顺序为(填小烧瓶号):______.
③影响铁生锈的因素有:______.
(4)“金属的防护”:对如何防止你的自行车的钢圈生锈提出两种方案.______.
(5)“金属的冶炼”:某钢铁厂日产含4%杂质的生铁2240吨.问:需要含Fe2O3质量分数为80%的赤铁矿石多少吨?