题目内容
某化工厂为测定氯化钠样品的纯度,取30g氯化钠样品(杂质为氯化钙)溶于水配制成263g溶液,再加入53g溶质质量分数为20%的碳酸钠溶液,恰好完全反应.求:反应后所得溶液中溶质的质量分数.
解:设与碳酸钠反应的氯化钙的质量为x,生成的氯化钠的质量为y,生成碳酸钙沉淀质量为z
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106 100 117
x 53g ×20% z y
 x=11.1g
x=11.1g
 y=11.7g
y=11.7g
 z=10g
z=10g
样品中含氯化钠的质量为:30g﹣11.1g=18.9g
所以反应后溶液中溶质氯化钠的质量为:18.9g+11.7g=30.6g
反应后溶液质量为:263g+53g﹣10g=306g反应后溶液中溶质的质量分数为: ×100%=10%
×100%=10%
答:反应后所得溶液中溶质的质量分数为10%
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106 100 117
x 53g ×20% z y
 x=11.1g
x=11.1g  y=11.7g
y=11.7g z=10g
z=10g样品中含氯化钠的质量为:30g﹣11.1g=18.9g
所以反应后溶液中溶质氯化钠的质量为:18.9g+11.7g=30.6g
反应后溶液质量为:263g+53g﹣10g=306g反应后溶液中溶质的质量分数为:
 ×100%=10%
×100%=10%答:反应后所得溶液中溶质的质量分数为10%

练习册系列答案
相关题目
浩瀚的海洋中蕴藏着丰富的自然资源,现摘取部分海水综合利用的方案如下:
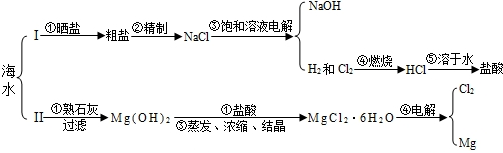
请根据下列部分酸碱盐溶解性表回答下列问题:
(1)除去粗盐中混有的少量不溶性杂质,下列操作顺序正确的是 (填编号,下同)
①过滤 ②溶解 ③蒸发
(2)过滤后所得滤液仍然浑浊,可能的原因是 ;
①滤纸破损 ②过滤时漏斗里的液面高于滤纸的边缘 ③漏斗颈下端管口没有紧靠烧杯内壁.
(3)如果海水中含有的可溶性杂质主要为CaCl2、MgSO4,则方案Ⅰ中步骤②“精制”时:欲沉淀杂质CaCl2,一般加入稍过量的碳酸钠溶液,此反应方程式为 ;
如果井水或溪水中含有Ca2+、Mg2+,这种水称作 ,如果在这种水中加入肥皂,会出现 .
(4)方案Ⅱ中步骤①生成Mg(OH)2的反应方程式为 ;
如果熟石灰是用海边的贝壳(主要成分为CaCO3)生成的,则生产熟石灰的反应方程式为: 、 .
(5)方案Ⅱ中除步骤①中用过滤外,还要用到“过滤”步骤的是 (填序号).
(6)下图是某种加钙食盐包装袋标签上的部分说明文字(Ca-40,C-12,O-16):
如果每袋加钙食盐含Ca为0.5%,则含CaCO3的质量为 g.
(7)某化工厂为测定氯化钠样品的纯度,取30g氯化钠样品(杂质为氯化钙)溶于水制成252g溶液,再加入53g溶质质量分数为10%的碳酸钠溶液,恰好完全反应.求:
①样品中杂质CaCl2的质量;
②样品中氯化钠的质量;
③样品中氯化钠的质量分数;
④反应后所得溶液中溶质的质量分数.

请根据下列部分酸碱盐溶解性表回答下列问题:
| OH- | Cl- | SO42- | CO32- | |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 微 | 不 |
| Ba2+ | 溶 | 溶 | 不 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 不 |
①过滤 ②溶解 ③蒸发
(2)过滤后所得滤液仍然浑浊,可能的原因是
①滤纸破损 ②过滤时漏斗里的液面高于滤纸的边缘 ③漏斗颈下端管口没有紧靠烧杯内壁.
(3)如果海水中含有的可溶性杂质主要为CaCl2、MgSO4,则方案Ⅰ中步骤②“精制”时:欲沉淀杂质CaCl2,一般加入稍过量的碳酸钠溶液,此反应方程式为
如果井水或溪水中含有Ca2+、Mg2+,这种水称作
(4)方案Ⅱ中步骤①生成Mg(OH)2的反应方程式为
如果熟石灰是用海边的贝壳(主要成分为CaCO3)生成的,则生产熟石灰的反应方程式为:
(5)方案Ⅱ中除步骤①中用过滤外,还要用到“过滤”步骤的是
(6)下图是某种加钙食盐包装袋标签上的部分说明文字(Ca-40,C-12,O-16):
| 配料表:氯化钠、食用碳酸钙、碘酸钾 净含量:500g 成分表:氯化钠≥88% 钙(以Ca计)(0.5-1.3)% 碘(以I计)(20-50)mg/kg |
(7)某化工厂为测定氯化钠样品的纯度,取30g氯化钠样品(杂质为氯化钙)溶于水制成252g溶液,再加入53g溶质质量分数为10%的碳酸钠溶液,恰好完全反应.求:
①样品中杂质CaCl2的质量;
②样品中氯化钠的质量;
③样品中氯化钠的质量分数;
④反应后所得溶液中溶质的质量分数.