题目内容
1. 最近,“铬超标胶囊”事件引起社会强烈关注.铬的毒性与其价态及含量有关.铬常用作合金的生产原料,铬元素也是哺乳动物所需的微量元素之一.如图是铬在元素周期表中的相关信息,请回答:
最近,“铬超标胶囊”事件引起社会强烈关注.铬的毒性与其价态及含量有关.铬常用作合金的生产原料,铬元素也是哺乳动物所需的微量元素之一.如图是铬在元素周期表中的相关信息,请回答:(1)铬原子的核电荷数是24;其相对原子质量为52.00.
(2)酒精监测仪中的反应原理为:C2H5OH+4X(红棕色)+6H2SO4═2Cr2(SO4)3(绿色)+2CO2↑+9H2O,则物质X的化学式为CrO3;Cr2(SO4)3中Cr的化合价为+3.
(3)据此信息,就物质或元素的安全性谈谈你的看法:合理使用.
分析 (1)根据元素周期表的意义会查元素的相对相对原子质量;
(2)根据质量守恒定律,在化学反应中,反应前后原子的种类、原子的个数不变,则可得出X的化学式.根据在化合物中正负化合价代数和为零,结合Cr2(SO4)3的化学式进行解答本题.
(3)根据物质的使用方法分析解答.
解答 解:
(1)由元素周期表的意义可知,铬原子的核电荷数是24,的相对原子质量是52.00.
(2)根据质量守恒定律可知,反应前后原子的种类没有改变,数目没有增减,故:反应前已知的原子个数:碳原子2个、氢原子18个、氧原子25个、硫原子6个;反应后原子个数:铬原子4个、硫原子6个、氧原子37个、碳原子2个、氢原子18个,故可知4X中含有铬原子4个和12个氧原子,故物质X的化学式为CrO3.根据在化合物中正负化合价代数和为零,硫酸根显-2价,设铬元素的化合价是x,可知Cr2(SO4)3中铬元素的化合价:2x+(-2)×3=0,则x=+3.
(3)再使用物质或元素的安全性方面合理使用;
答案:
(1)24;52.00;
(2)CrO3;+3;
(3)合理使用.
点评 本题主要考查学生运用质量守恒定律进行推断的能力;掌握有关化学式的计算和推断方法.通过本题的练习,会写离子的符号,了解原子结构示意图中各部分的意义,会查元素周期表中有关的数据.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
11.往100g谁在加入固体A或改变温度,得到相应的溶液①~③.下列说法正确的是( )
25℃100g水 $→_{37.2g}^{加入A}$ ①$→_{4.2g}^{加入A}$ ②$→_{至60℃}^{升温}$ ③
25℃100g水 $→_{37.2g}^{加入A}$ ①$→_{4.2g}^{加入A}$ ②$→_{至60℃}^{升温}$ ③
| 资料:A的溶解度 | ||
| 温度/℃ | 25 | |
| 溶解度/g | 37.2 | 55.2 |
| A. | ①中A的质量分数最大 | B. | ②③溶液中A的质量分数相等 | ||
| C. | ①溶液为饱和溶液 | D. | ①中有固体存在 |
16.下列组合不能验证镁、铁、铜三种金属的活动性顺序的是( )
| A. | 铁、铜、氯化镁溶液 | B. | 镁、铁、氯化铜溶液 | ||
| C. | 镁、氯化铜溶液、氯化亚铁溶液 | D. | 铁、氯化铜溶液、氯化镁溶液 |
12.下列各组物质中,所含分子数相同的是( )
| A. | 224mL H2(标准状况)和0.5molN2 | B. | 5.6L N2(标准状况)和5.6g CO2 | ||
| C. | 11.2L H2O(标准状况)和0.5molBr2 | D. | 10g N2和10g CO |
13.下列图象能正确反映对应变化关系的是( )
| A. |  20℃时,向一定量的水中不断加入硝酸钾固体 | |
| B. |  向等质量等质量分数的稀硫酸中分别加入足量等质量的锌和铁 | |
| C. |  向盐酸和硫酸钠的混合溶液中逐滴加入氢氧化钡溶液 | |
| D. |  向盛有少量二氧化锰的烧杯中不断加入过氧化氢溶液 |
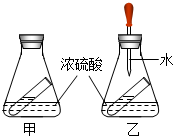 如图是小婧对硫酸的一些性质的探究,锥形瓶内的小试管盛装饱和的澄清石灰水.
如图是小婧对硫酸的一些性质的探究,锥形瓶内的小试管盛装饱和的澄清石灰水. 自行车是比较常见的一种交通工具.制作自行车使用最多的金属是铁.铁在空气中往往容易生锈.人们为了防止铁制品生锈.在自行车的不同部位采取不同的防锈措施.例如:支架采取的防锈措施是刷漆,其防锈原理是隔绝氧气和水.
自行车是比较常见的一种交通工具.制作自行车使用最多的金属是铁.铁在空气中往往容易生锈.人们为了防止铁制品生锈.在自行车的不同部位采取不同的防锈措施.例如:支架采取的防锈措施是刷漆,其防锈原理是隔绝氧气和水.