题目内容
20.小黄为了测定某稀盐酸溶质的质量分数,将146.0g 的稀盐酸倒入盛有足量锌粉的烧杯中,恰好完全反应,实验过程如图所示.(反应的化学方程式为Zn+2HCl=ZnCl2+H2↑)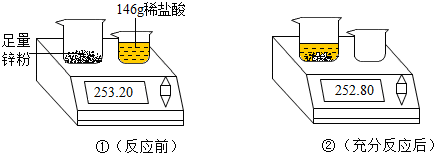
试计算:
(1)根据质量守恒定律,可知生成氢气0.40g.
(2)试计算稀盐酸中溶质的质量分数.
分析 (1)根据质量守恒定律求出生成氢气的质量;
(2)根据锌与稀盐酸的反应,由氢气的质量求出盐酸中溶质的质量,再求出稀盐酸中溶质的质量分数.
解答 解:(1)由质量守恒定律可知,生成氢气的质量为:253.20g-25208.g=0.40g
(2)设稀盐酸中溶质质量为x.
Zn+2HCl═ZnCl2+H2↑
73 2
x 0.40g
$\frac{73}{2}=\frac{x}{0.40g}$ x=14.60g
$\frac{14.60g}{146g}×100%$=10%
故答为:(1)0.40;(2)稀盐酸的溶质质量分数为10%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,比较简单,计算时要注意规范性和准确性.

练习册系列答案
相关题目
11.下列实验操作中正确的是( )
| A. | 尝药品的味道 | |
| B. | 用剩的药品放入指定的回收容器中 | |
| C. | 量筒用作反应器 | |
| D. | 加热试管中的液体时试管口对着他人 |
15.下表实验操作能达到目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 检验二氧化碳 | 将二氧化碳通入紫色石蕊溶液中 |
| B | 鉴别氮气和二氧化碳 | 将燃着的木条分别伸入瓶中 |
| C | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、蒸发 |
| D | 除去硫酸亚铁溶液中少量的硫酸铜 | 加足量铁粉充分反应后,过滤 |
| A. | A | B. | B | C. | C | D. | D |
5.洗发水中一般含有少许二恶烷(化学式是C4H8O2),二恶烷主要用作溶剂、乳化剂、去垢剂等.下列有关二恶烷的说法正确的是( )
| A. | 二恶烷属于有机高分子化合物 | |
| B. | 二恶烷中含有4个碳原子、8个氢原子和2个氧原子 | |
| C. | 二恶烷中碳元素的质量分数约是54.5% | |
| D. | 二恶烷中碳、氢、氧三种元素的质量比是2:4:1 |
9.不粘锅内表面通常使用特氟龙涂层,原料为聚四氟乙烯,其结构简式为[CF2CF2]n.对聚四氟乙烯的推断,不合理的是( )
| A. | 属于有机合成材料 | B. | 有较好的耐高温性 | ||
| C. | 可耐酸腐蚀 | D. | 可溶于酒精、食用油等有机溶剂 |
19.如图是甲、乙两种物质的溶解度曲线,则下列叙述正确的是( )
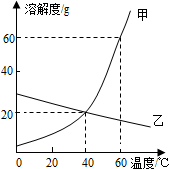

| A. | 50℃时,甲物质的溶解度大于乙物质的溶解度 | |
| B. | 40℃时,甲、乙两物质溶液的溶质质量分数一定相等 | |
| C. | 升高温度可以将乙的饱和溶液转化为不饱和溶液 | |
| D. | 可用100g水配制60℃时溶液质量为180g的甲溶液 |
 海洋是一座巨大的宝库,海水中蕴含着 80 多种元素.氯碱工业就是以海水为原材料来大量制取烧碱和氯气.烧碱和氯气是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于工业生产.
海洋是一座巨大的宝库,海水中蕴含着 80 多种元素.氯碱工业就是以海水为原材料来大量制取烧碱和氯气.烧碱和氯气是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于工业生产. 眼镜是人们常用的护眼工具,如右图是一款变色眼镜的示意图:
眼镜是人们常用的护眼工具,如右图是一款变色眼镜的示意图: