题目内容
1.实验室的药品须分类摆放.如图是四个药品橱的部分药品目录,硫酸钠应该放在( )| A. |  | B. |  | C. |  | D. |  |
分析 在化学药品的保存中,一般根据物质的类别来保存,根据物质的组成和性质来分析物质的类别,利用单质、酸、碱、盐的概念来判断物质是否属于同一类别.
解答 解:硫酸钠是由钠离子和硫酸根离子构成的化合物,属于盐,故应将它存放在盛放盐的药品橱中.
A、镁带、锌粒均是由一种元素组成的纯净物,均属于单质,故选项错误;
B、盐酸、硫酸均是电离时产生的阳离子全部是氢离子的化合物,均属于酸,故选项错误.
C、氢氧化钠、氢氧化钙均是由金属阳离子和OH-构成的,均属于碱,故选项错误.
D、氯化镁、碳酸钾均是由金属阳离子和酸根离子构成的,均属于盐,故选项正确.
故选:D.
点评 本题难度不大,考查物质类别的判别,抓住单质、酸、碱、盐的特征、熟悉常见的物质的组成是正确解答本题的关键.

练习册系列答案
相关题目
11.下列说法中,不正确的是( )
| A. | 通过闻气味的方法可以鉴别酱油与食醋 | |
| B. | 利用C、CO、H2的还原性来冶炼金属 | |
| C. | 推广使用可降解的塑料制品 | |
| D. | 在猪饲料中添加瘦肉精以满足人们对瘦猪肉的需求 |
12.如图是初中化学中实验室制取气体的两种基本装置和三种常用的收集方法,请比较装置A和装置B的差异:


| 装置A | 装置B | |
| 反应状态 | 固体反应生成气体 | 固体和液体反应生成气体 |
| 反应条件 | 加热 | 无需加热 |
6.几年前,一辆载满20t电石的挂车,在浙江滨江区燃起熊熊大火并伴有大量黑烟.事故路面上洒落了五六百米燃着的石头.这辆货车在雨中整整燃烧了一天,消防官兵对大火也束手无措,场面让人震撼.大家对电石的化学性质产生了浓厚的兴趣,请你一起与他们完成下列探究活动.
【查阅资料】电石的主要成分是碳化钙(CaC2),可以与水反应生成一种可燃性气体及白色固体.常见的可燃性气体中,乙炔(C2H2)燃烧时伴有大量黑烟.
【猜想与假设】电石与水反应生成的可燃性气体是:氧气、氢气或乙炔(C2H2);电石与水反应生成的白色固体是:氧化钙、氢氧化钙或碳酸钙.大家做出以上推断的理由是质量守恒定律反应前后元素的种类不变
大家讨论后一致认为该气体不可能是氧气,原因是氧气不能燃烧,白色固体不可能是氧化钙,原因是(用化学方程式表示)CaO+H2O=Ca(OH)2.
【实验探究】
【查阅资料】电石的主要成分是碳化钙(CaC2),可以与水反应生成一种可燃性气体及白色固体.常见的可燃性气体中,乙炔(C2H2)燃烧时伴有大量黑烟.
【猜想与假设】电石与水反应生成的可燃性气体是:氧气、氢气或乙炔(C2H2);电石与水反应生成的白色固体是:氧化钙、氢氧化钙或碳酸钙.大家做出以上推断的理由是质量守恒定律反应前后元素的种类不变
大家讨论后一致认为该气体不可能是氧气,原因是氧气不能燃烧,白色固体不可能是氧化钙,原因是(用化学方程式表示)CaO+H2O=Ca(OH)2.
【实验探究】
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取适量电石加水反应,收集生成的气体,验纯后点燃. | 气体燃烧,产生黄色火焰并伴有浓烈黑烟. | 电石与水反应产生的气体是乙炔(C2H2) |
| (2)取适量反应后生成的固体于试管中,滴加过量稀盐酸. | 固体溶解,不产生气泡. | 电石与水反应产生的固体不是碳酸钙 |
| (3)取适量反应后生成的固体于试管中加水,向上层清液中滴加2~3滴无色酚酞. | 溶液变红 | 电石与水反应产生的固体是氢氧化钙 |
13.体育课上同学们在做引体向上时常用“镁粉”搓手,以起到防滑效果.某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究.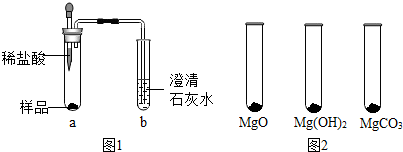
已知:MgO+2HCl═MgCl2+H2O MgCO3+2HCl═MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3.
①取少量样品,如图1所示进行实验,观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有MgCO3.
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭,但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是除掉二氧化碳.小明按照修改后的实验方案重复上述实验,观察到b试管口,证明“镁粉”中不含Mg.
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2.
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验,分别取0.5g三种固体粉末,每次取样方法如图2所示:
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失,在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
Mg(OH)2与盐酸发生中和反应的化学方程式为Mg(OH)2+2HCl═MgCl2+2H2O.
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解,此时消耗稀盐酸的体积约为5.3mL.
【实验分析及结论】
“镁粉”不只含有MgCO3,理由是0.5gMgCO3消耗的盐酸体积与0.5g“镁粉”消耗的盐酸体积不相等.
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5gMgCO3,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL,由此可知“镁粉”中含有MgCO3的质量分数为85%,“镁粉”中除MgCO3外的另一种物质为Mg(OH)2.

已知:MgO+2HCl═MgCl2+H2O MgCO3+2HCl═MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3.
①取少量样品,如图1所示进行实验,观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有MgCO3.
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭,但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是除掉二氧化碳.小明按照修改后的实验方案重复上述实验,观察到b试管口,证明“镁粉”中不含Mg.
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2.
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验,分别取0.5g三种固体粉末,每次取样方法如图2所示:
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失,在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解,此时消耗稀盐酸的体积约为5.3mL.
【实验分析及结论】
“镁粉”不只含有MgCO3,理由是0.5gMgCO3消耗的盐酸体积与0.5g“镁粉”消耗的盐酸体积不相等.
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5gMgCO3,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL,由此可知“镁粉”中含有MgCO3的质量分数为85%,“镁粉”中除MgCO3外的另一种物质为Mg(OH)2.


 水是生命的源泉,也是不可缺少的资源.
水是生命的源泉,也是不可缺少的资源.
