题目内容
18.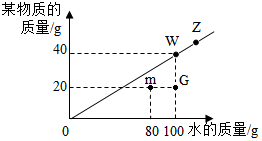 t℃时,根据某物质在不同质量的水中达到饱和状态时所溶解物质的质量,绘制成如图中斜线.请回答下列问题:
t℃时,根据某物质在不同质量的水中达到饱和状态时所溶解物质的质量,绘制成如图中斜线.请回答下列问题:(1)该物质的溶解度随温度的升高而无法确定(“增大”、“减小”或“无法确定”);若使该物质的不饱和溶液变为饱和溶液最可靠的方法是增加溶质.
(2)t℃时,将该物质20g加入50g水中充分溶解,所得溶液为饱和溶液(填“饱和”、“不饱和”或“无法确定”).
(3)图中4个点G、m、w、z表示的溶液中溶质质量分数的关系是:G<m<w=z.
分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)此图未能提供不同温度下该物质的溶解能力,所以该物质的溶解度随温度的升高而无法确定,使该物质的不饱和溶液变为饱和溶液最可靠的方法是增加溶质;
(2)t℃时,在100g的水中能溶解40g的某物质,所以将该物质20g加入50g水中充分溶解,所得溶液为饱和溶液;
(3)G和m的区别是G中有100g水,m中有80g水,溶质相同都是20g,所以G中溶质质量分数要小于m中质量分数,G、m都是该温度下的不饱和溶液,w和z都在曲线上,都属于饱和溶液:饱和溶液的质量分数:$\frac{溶解度}{100g+溶解度}$×100%,有因为温度没变,溶解度就不变,所以w和z溶质质量分数相同,因为在同一温度,同一溶质饱和溶液的质量分数最大,所以图中4个点表示的溶液中溶质质量分数的关系是:G<m<w=z.
故答案为:(1)无法确定,增加溶质;
(2)饱和;
(3)G<m<w=z.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
8. 如图为元素周期表的一部分,下列有关说法中,错误的是( )
如图为元素周期表的一部分,下列有关说法中,错误的是( )
 如图为元素周期表的一部分,下列有关说法中,错误的是( )
如图为元素周期表的一部分,下列有关说法中,错误的是( )| A. | 钾原子的质子数为19 | B. | 钾的相对原子质量是39.10g | ||
| C. | 钾是一种金属元素 | D. | 钾元素的原子序数为19 |
6.在托盘天平的两边各放一只烧杯,调节天平平衡,在两侧的烧杯中分别加入100克质量分数为9.8%的稀硫酸,天平再次保持平衡.先向右盘中加入5.6克的铁,至恰好完全反应,则向左盘中加入与铁等质量的下列哪种金属,天平将失去平衡( )
| A. | Mg | B. | Zn | C. | Cu | D. | Al |
3.下列有关概念的辨析中正确的是( )
| A. | 与纯金属一样,合金也具有金属特性 | |
| B. | 均一、稳定的液体都是溶液 | |
| C. | pH<7的雨水叫做酸雨 | |
| D. | 由多种元素组成的物质一定是化合物 |
7.物质X与Ca(OH)2水溶液发生反应的化学方程式为:X+Ca(OH)2=Y+Cu(OH)2↓,下列说法正确的是( )
| A. | X可能是酸 | B. | X和Y的相对分子质量之差为24 | ||
| C. | X可能是单质,也可能是化合物 | D. | Y只可能是CaCl2 |
9.下列图象分别与选项中的实验过程相对应,其中正确的是( )
| A. | 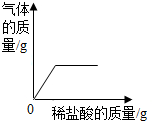 向部分变质的氢氧化钠溶液中滴加稀盐酸 向部分变质的氢氧化钠溶液中滴加稀盐酸 | |
| B. | 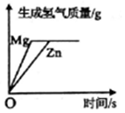 相同质量的镁、锌分别与足量的溶质质量分数相同的稀盐酸反应 相同质量的镁、锌分别与足量的溶质质量分数相同的稀盐酸反应 | |
| C. | 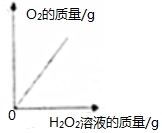 向二氧化锰中加入一定质量的过氧化氢溶液 向二氧化锰中加入一定质量的过氧化氢溶液 | |
| D. | 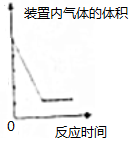 测定空气中氧气的含量 测定空气中氧气的含量 |
 材料的应用和发展与人类文明、进步紧密相关,在日常生活中已得到越来越广泛的应用.
材料的应用和发展与人类文明、进步紧密相关,在日常生活中已得到越来越广泛的应用.