题目内容
9.“碱石灰”是实验室常用的干燥剂,主要成分是氧化钙(CaO,约占75%),氢氧化钠(NaOH,约占3%),水和其它物质(约占22%)的混合物.CaO和固体NaOH都极易与空气中水蒸气或CO2反应而变质(水和其它物质变化情况不考虑).某同学对一瓶久置于空气中的“碱石灰”变质情况作了如下探究:(1)【猜想】
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3.则CaO与水反应的反应方程式为:CaO+H2O=Ca(OH)2.
(2)【实验】如图所示:

(3)【判断】
根据资料显示:把Ca(OH)2、CaCO3和Na2CO3投入到水中是不会放热的,由操作②现象判断:猜想Ⅱ不成立(填“成立”或“不成立”).由操作⑤⑥的现象判断:滤液中含有Na2CO3(写化学式);由此判断猜想Ⅰ不成立(填“成立”或“不成立”).综合上述结论,判断该样品变质情况应为部分变质.
(4)【拓展】由上述实验说明,实验室中放置“碱石灰”应注意密封保存.
分析 根据氧化钙和水反应产生氢氧化钙写出反应的方程式;根据碳酸钠、碳酸钙与盐酸反应产生气泡;根据现象得出结论.
解答 解:【猜想】氧化钙与水反应产生氢氧化钙;故反应的方程式为:CaO+H2O=Ca(OH)2;
【判断】(1)混合物加水后试管壁发热,但是Ca(OH)2、CaCO3和Na2CO3加入水中不会放出热量,因此一定含有氧化钙或氢氧化钠,则猜想Ⅱ不成立;浑浊液中的滤渣中滴加盐酸,产生气泡,说明混合物中有碳酸钙;滤液中滴加盐酸有气泡,加澄清石灰水有沉淀生成,说明滤液中有碳酸钠,因此是部分变质,则猜想Ⅰ不成立;由操作⑤⑥的现象判断滤液中含有碳酸钠;故填:不成立;Na2CO3;不成立;部分变质;
【反思与评价】通过实验可知,碱石灰在空气中极易变质,因此应该密闭保存.故填:密闭.
点评 本题属于物质变质程度的探究,依据实验的现象得出结论,结合相关物质的性质分析即可,难度不大.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
19.下列溶液中通入(加入)括号中的物质,能使溶液的pH明显增大的是( )
| A. | 饱和石灰水(二氧化碳) | B. | 稀硫酸(氯化钡) | ||
| C. | 氢氧化钙的饱和溶液(碳酸钠) | D. | 稀盐酸(氢氧化钠溶液) |
17.产生下列现象时,物质发生化学变化的是( )
| A. | 石蜡熔化 | B. | 干冰升华 | C. | 美酒飘香 | D. | 铁丝生锈 |
4.现有甲、乙两包白色固体,已知甲中含有NaCl、NaNO3、Na2CO3、NaOH中的一种或几种,乙为纯净物,是初中化学学习中涉及到的物质.为了证明甲、乙两包固体的成分,现进行如下实验:
(1)实验一
(2)实验二(部分物质在流程图中未列出)
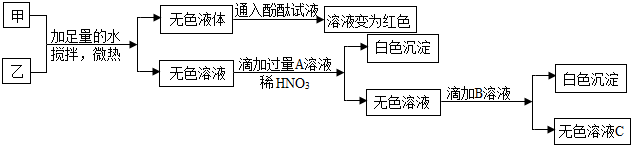
根据以上实验推断,乙物质为(NH4)2SO4(填写化学式,下同),A溶液是Ba(NO3)2,C中一定存在的溶质有NaCl、Ba(NO3)2、NaNO3.
(1)实验一
| 操作步骤 | 实验现象 | 结论 |
| ①取甲中少量粉末加足量水充分溶解 | 溶液呈无色 | 固体都易溶于水 |
| ②取①中所得溶液少量,滴加紫色石蕊试液 | 石蕊试液变了蓝色 | 溶液pH>7(填“>”、“<”或“=”) |
| ③另取①中所得溶液少量,滴加稀盐酸 | 无明显现象 | 甲中一定含有NaOH(填化学式,下同),一定不含Na2CO3,可能含有NaCl、NaNO3. |

根据以上实验推断,乙物质为(NH4)2SO4(填写化学式,下同),A溶液是Ba(NO3)2,C中一定存在的溶质有NaCl、Ba(NO3)2、NaNO3.
4.在密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表:
下列说法正确的是C
A.反应后X的质量为4g B.该反应类型一定是化合反应
C.该反应中的X、Z的质量比是l:3 D.Q一定是催化剂.
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 8 | 2 | 20 | 5 |
| 反应后质量/g | 待测 | 10 | 8 | 5 |
A.反应后X的质量为4g B.该反应类型一定是化合反应
C.该反应中的X、Z的质量比是l:3 D.Q一定是催化剂.
6.N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料,下列有关说法正确的是( )
| A. | N(NO2)3的相对分子质量152 | B. | 每个N(NO2)3分子由9个原子构成 | ||
| C. | N(NO2)3由三种元素组成 | D. | N(NO2)3中氮元素的质量分数为18.4% |
 如图是ABC三种物质的溶解度曲线图,在t1时,三种物质的溶解度从小到大的顺序为A=C<B在t2时,给我们的信息是:
如图是ABC三种物质的溶解度曲线图,在t1时,三种物质的溶解度从小到大的顺序为A=C<B在t2时,给我们的信息是: