题目内容
16.取不纯的铁的样品6g,与100g某稀硫酸恰好完全反应(杂质不与稀硫酸反应,也不溶于水),反应后得到105.8g溶液,求原样品中铁的纯度.分析 根据质量守恒定律,由反应前后物质的总质量的差求得反应放出氢气的质量;由生成氢气的质量,根据反应的化学方程式,计算参加反应的铁的质量,由铁的质量求铁样品中铁的质量分数.
解答 解:根据质量守恒定律,反应放出氢气的质量=100g+6g-105.8g=0.2g
(2)设恰好完全反应消耗铁的质量为x
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.2g
$\frac{56}{x}=\frac{2}{0.2g}$
x=5.6g
原样品中铁的纯度=$\frac{5.6g}{6g}×$100%≈93.3%.
答案:原样品中铁的纯度为93.3%.
点评 根据质量守恒定律,找出反应所放出氢气的质量,体现分析问题、解决问题的能力.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
4.如图所示,在盛水的小试管里放入下列哪种物质后,U型管内的水面a比b低?( )


| A. | 熟石灰 | B. | 生石灰 | C. | 食盐 | D. | 白糖 |
8.在M+2O2═CO2+2H2O中,依质量守恒定律,可判断M为( )
| A. | CH3OH | B. | C2H5OH | C. | CH3COOH | D. | CH4 |
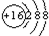 所表示的粒子符号为S2-;
所表示的粒子符号为S2-;